
����Ŀ��25��ʱ������һ��c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)=0.100 mol��L��1��H3PO4��NaOH�����Һ����Һ�в����������ʵ���Ũ����pH�ı仯������ͼ��ʾ������ָ����Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����
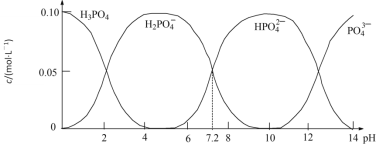
A.pH=6����Һ�У�c(H3PO4)+c(HPO42-)��c(H2PO4-)
B.c(Na+)=0.100mol��L��1����Һ�У�c(H3PO4)=2c(PO43-)+c(HPO42-)
C.pH =7����Һ�У�c(Na+)��2c(HPO42-)+c(H2PO4-)
D.c(H3PO4)=c(H2PO4-)����Һ�У�c(Na+)��0.100mol��L��1 +2c(PO43-)+c(HPO42-)
���𰸡�CD
��������
A��pH��6 ����Һ��Ҫ��H2PO4������Һ����ʱ�����ѳ�ַ�Ӧ��c(H3PO4)+c(HPO42��)��c(H2PO4��)����A����
B��c(Na+)��0.100 molL��1����Һ��c(PO43��)+c(HPO42��)+c(H2PO4��)��0.100molL��1��c(Na+)����Һ��������Ҫ��NaH2PO4����ͼ���֪��H2PO4����ˮ��̶�С�ڵ���̶ȣ����ɵ�H3PO4���٣���2c(PO43��)+c(HPO4��)��c(H3PO4)����B����
C��pH��7.2����ҺΪ��Ũ�ȵ�NaH2PO4��Na2HPO4��pH��7 ����ҺNaH2PO4��Ũ���Դ���Na2HPO4����Һ������Ũ��c(Na+)��2c(HPO42��)��c(H2PO4��)����C��ȷ��
D��c(H3PO4)��c(H2PO4��)����ҺpH��2����c(H+)��c(OH��)����Һ�д��ڵ���غ㣺c(Na+)+c(H+)��c(OH��)+c(H2PO4��)+2c(HPO42��)+3c(PO43��)��c(PO43��)+c(HPO42��)+c(H2PO4��)��0.100molL��1���õ�c(Na+)��0.100molL��1+2c(PO43��)+c(HPO42��)����D��ȷ��
�ʴ�ΪCD��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������ǿ������Һ����Ҫ��HO2-���ڡ��ҹ��о���Al-H2O2ȼ�ϵ�ؿ��������Դ�Ŀ��顢�������ȹ����Ƽ�����װ��ʾ��ͼ���¡�����˵���������
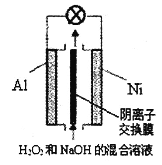
A. ��ع���ʱ����Һ��OH-ͨ�������ӽ���Ĥ��Al��Ǩ��
B. Ni���ĵ缫��Ӧʽ��HO2-+2e-+H2O=3OH-
C. ��ع��������������Һ��pH����
D. Al�缫��������13.5g����·��ͨ��9.03��1023������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��ҵ������ұ����������һ����ԭ�Ͻ��ʯת�����䷴Ӧ����ʽΪ��TiO2�����ʯ��+2C+2Cl2=TiCl4+2CO
��֪��
��C(s)+O2(g)=CO2(g) ��H=-393.5kJ��mol-1��
��2CO(g)+O2(g)=2CO2(g) ��H=-566kJ��mol-1��
��TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ��H=+141kJ��mol-1��
��1��CO��ȼ������___��
��2����д�����ʯת�����Ȼ�ѧ����ʽ___��
II.��ͼ��ʾ������ʵ��װ���У��ס�������װ�õĵ�ط�Ӧ��ΪZn+Cu2+=Zn2++Cu��������װ�к���֬�ı���KCl��Һ���ش������й����⣺
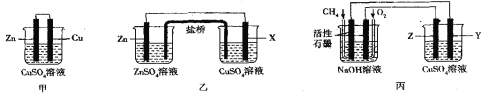
��1����װ����ͭ�缫�ϵĵ缫��ӦʽΪ___��
��2���ŵ�ʱ�����е�Cl-�����������װ��__����������������������������У�X�缫�ijɷֲ�������__������ĸ��
a��ͭ b���� c��ʯī d����
��3���ñ�װ�������϶�ͭ����缫����Ϊ������__������Y��Z�����������ϵĵ缫��ӦʽΪ___��
��4����������ij�缫����������1.6gʱ�������ĵ�O2�ڱ���µ������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���KCl��BaCl2���ֹ�������Իش��������⣺
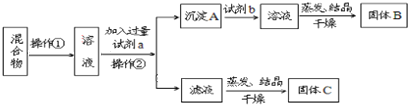
��1�������ٵ�������___________�������ڵ�������____________��
��2���Լ�a��___________�Լ�b��___________������B��___________�����ѧʽ��
��3�������Լ�a�����������ӷ���ʽΪ��______________________�������Լ�b�����������ӷ���ʽΪ��_____________________��
��4���÷����ܷ�ﵽʵ��Ŀ�ģ�_______�������ܣ�Ӧ��θĽ������ܣ����ʲ��ûش�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��O2��������Z(Na2CO3)��ɵ�ȼ�ϵ�أ����õ�ⷨ����COͬʱ�Ʊ�N2O5��װ����ͼ��ʾ������YΪCO2������˵������������
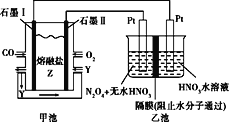
A.ʯī����ԭ��صĸ���������������Ӧ
B.�׳��е�CO32����ʯī���ƶ�
C.ʯī��ĵ缫��Ӧʽ��CO+CO32����2e��=2CO2
D.���׳����ı�״���µ�����2.24L�����ҳ��в�������0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���������̿�(��Ҫ�ɷ�ΪMnO2��������������������ͭ�����Ƚ���������)���������ͨ�����¼����̼��ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2(��Ӧ������ʡ��)��

��ش��������⣺
��1�����и����Լ��У���ȷ�ⶨһ�����ȼúβ����SO2��������___(����)��
a��NaOH��Һ����̪��Һ b��ϡH2SO4�ữ��KMnO4��Һ
c����ˮ��������Һ d����ˮ����̪��Һ
��2��д�����̿�����SO2 �����ӷ���ʽ___��
��3����MnCO3�ܳ�ȥ��Һ�е�Al3+��Fe3+����ԭ����___��
��4��д��KMnO4��MnSO4��Һ��Ӧ�����ӷ���ʽ___��
��5����ҵ�ϲ��õ��K2MnO4ˮ��Һ�ķ���������KMnO4���������Ե缫��������������������д�������ĵ缫��Ӧʽ___��
��6�����Ӻ�õ���MnSO4��Һ����ͨ��___(���������)�������Ƶ������̾��塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2��8NH3��7N2��12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ��
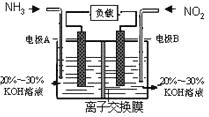
����˵������ȷ����
A. �������Ҳ�缫�������غ��������缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ��2NH3��6e����N2��6H��
D. ����4.48LNO2(��״��) ������ʱ��ת�Ƶ���Ϊ0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��I�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮�����ϵ����ͼ��ʾ(���ַ�Ӧ�������û���г�)����֪HΪ��̬�����F�Ǻ��ɫ������ˮ�ij�������A��B��C��D��E��F���������о���ͬһ��Ԫ�ء�

����д���пհף�
(1)A��B��C��D��E��F����������������ͬһ��Ԫ�ص�������________��
(2)��Ӧ�ٵĻ�ѧ����ʽΪ_____________________________________
��Ӧ�۵����ӷ���ʽΪ________________________
��Ӧ��Ļ�ѧ����ʽΪ_____________________________________
��3����Ӧ�����е�������______________________________��
��4��1molI������Ӧ�����ɵ�A��������������ˮ������Ӧ�����ɵ����廻��ɱ�״����ռ______L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com