
【题目】草酸锌晶体是一种微溶于水的白色粉末,可用于制纳米氧化锌、照相乳剂等。以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料生产草酸锌晶体(ZnC2O4·2H2O)的流程如下:
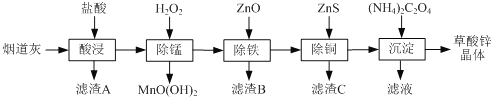
下列说法不正确的是( )
A.滤渣A、滤渣B的主要成分分别为SiO2和Fe(OH)3
B.“除锰”时发生的离子反应为Mn2++H2O2+H2O=MnO(OH)2↓+2H+
C.流程中“除铁”与“除铜”顺序可以颠倒
D.“合成”时过滤所得滤液主要溶质为NH4Cl
【答案】C
【解析】
用盐酸酸浸时SiO2不溶解,过滤分离,滤渣A为SiO2,滤液中加入过氧化氢进行除锰,再调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤,滤液中再加入ZnS,Cu2+转化为CuS沉淀,过滤除去,滤液中主要为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等。
A、由分析可知,滤渣A为SiO2,滤渣B为Fe(OH)3,故A正确;
B、除锰过程中产生MnO(OH)2沉淀,根据电荷守恒应有氢离子生成,反应离子方程式为:Mn2++H2O2+H2O=MnO(OH)2↓+2H+,故B正确;
C、除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是:先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去,故C错误;
D、由分析知,“合成”时过滤所得滤液主要溶质为NH4Cl,故D正确。
答案选C。


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】脱硫废水的主要超标项目为悬浮物、重金属阳离子(Hg2+、Cu2+等)、SO42-。某工厂采用如下流程进行脱硫废水处理。其中助凝剂为聚丙烯酰胺![]()
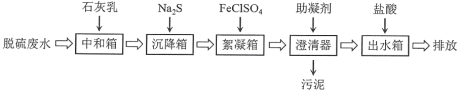
下列说法不正确的是
A.该方案用石灰乳仅用来调节pH使大部分重金属阳离子形成氢氧化物沉淀
B.加入Na2S可以将进入沉降箱的Hg2+,Cu2+转化为硫化物沉淀
C.加入FeClSO4是利用Fe3+易水解的性质,形成胶体吸附悬浮物
D.助凝剂聚丙烯酰胺是加成聚合反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算:
(1)同温同压下,等质量的SO2气体和CO气体密度之比为________;体积比为________;原子个数比为________。
(2)某混合溶液中只含有下列几种离子:Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为0.2mol/L、0.25mol/L、0.5mol/L、0.25mol/L,则c(Al3+)=________。
(3)在标准状况下,某混合气体密度是2.86gL-1,该混合气体的平均相对分子质量是________;现有质量比为11:7的CO2和CO的混合气体,该混合气体的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.SO2通入紫色石蕊试液中,溶液先变红,后褪色
B.向FeCl3和BaCl2溶液中分别通入CO2和SO2都无沉淀物产生
C.干燥的氯气能使红色的鲜花褪色
D.碳与二氧化硅在高温下反应可制得粗硅并产生二氧化碳气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:
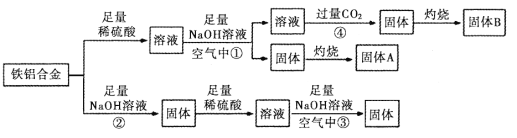
(1)铁铝合金是一种高电磁性能合金,下列有关推测不正确的是_______________(填序号)
a. 铁可由铁和铝熔融制成
b. 铁熔点高于铝和铁
c. 铁铝合金硬度高于纯铝
(2)反应①结束后,需要进行的操作中除使用烧杯外 ,还需使用的玻璃仪器有_____________。
(3)反应②的离子方程式_______________________________________。
(4)反应③发生时观察到的现象是_________________________________________。
(5)反应④中的CO2不宜换成HCl,原因是_________________________________________。
(6)固体A是一种红色颜料。将一定量固体A溶于160mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为_________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入适量( )
①浓盐酸 ②NaCl固体 ③浓氨水 ④ NaOH固体
A. ①②B. ③C. ③④D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.Al2O3+2OH﹣=AlO2﹣+H2O
B.NH4++OH﹣![]() NH3H2O
NH3H2O
C.SO2+H2O+Ca2++2ClO﹣=CaSO3↓+2HClO
D.2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
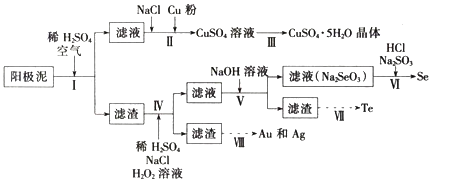
已知:①阳极泥的主要化学成分,如表所示:
主要成分 | Cu Ag Au Se Te |
百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
固定浸出温度 | 固定H2SO4浓度 | |||
H2SO4浓度 / mol·L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,发生的主要反应的化学方程式为__________;分析表2数据,可知步骤I最适合的条件为______________。
(2)步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为________。
(3)步骤III的操作方法为___________。
(4)步骤IV中,反应温度为75℃。加入H2O2溶液作用为______________;此过程中H2O2溶液的添加量要远远高于理论值,原因为_____________。
(5)步骤VI中所发生反应的化学方程式为_______。
(6)步骤VII中,碱性环境下电解Na2TeO3溶液可得Te实现,阴极的电极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com