
【题目】某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:
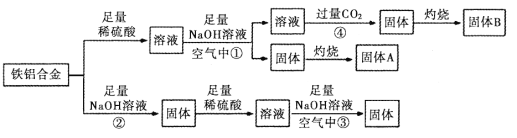
(1)铁铝合金是一种高电磁性能合金,下列有关推测不正确的是_______________(填序号)
a. 铁可由铁和铝熔融制成
b. 铁熔点高于铝和铁
c. 铁铝合金硬度高于纯铝
(2)反应①结束后,需要进行的操作中除使用烧杯外 ,还需使用的玻璃仪器有_____________。
(3)反应②的离子方程式_______________________________________。
(4)反应③发生时观察到的现象是_________________________________________。
(5)反应④中的CO2不宜换成HCl,原因是_________________________________________。
(6)固体A是一种红色颜料。将一定量固体A溶于160mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为_________g
【答案】b 漏斗、玻璃棒 2Al+2OH-+2H2O=2AlO2-+3H2↑ 先产生白色沉淀,之后迅速变成灰绿色最后变为红褐色 过量的氯化氢会使生成的氢氧化铝溶解 11.2
【解析】
铁铝合金加入足量稀硫酸溶解得到硫酸铝和硫酸亚铁混合溶液,再加入足量氢氧化钠溶液(在空气中),过滤得到溶液为偏铝酸钠等溶液,固体为氢氧化铁沉淀,灼烧得到固体A为氧化铁,溶液中通入过量二氧化碳得到氢氧化铝沉淀,灼烧得到固体B为氧化铝。若铁铝合金加入足量氢氧化钠溶液,铝溶解,过滤得到固体为铁,加入足量稀硫酸得到硫酸亚铁溶液,加入足量氢氧化钠溶液中在空气中久置生成氢氧化铁;参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量。
铁铝合金加入足量稀硫酸溶解得到硫酸铝和硫酸亚铁混合溶液,再加入足量氢氧化钠溶液(在空气中),过滤得到溶液为偏铝酸钠等溶液,固体为氢氧化铁沉淀,灼烧得到固体A为氧化铁,溶液中通入过量二氧化碳得到氢氧化铝沉淀,灼烧得到固体B为氧化铝。若铁铝合金加入足量氢氧化钠溶液,铝溶解,过滤得到固体为铁,加入足量稀硫酸得到硫酸亚铁溶液,加入足量氢氧化钠溶液中在空气中久置生成氢氧化铁。
(1)a.合金可以由各组分熔融混合制成,故a正确;
b.铁铝合金的熔点低于铝和铁的,故b错误;
c.合金硬度高于各成分,铁铝合金硬度高于纯铝的,故c正确,
故选:b;
(2)反应①结束后,需要进行的操作是过滤,除使用烧杯外,还需使用的玻璃仪器有:漏斗、玻璃棒,故答案为:漏斗、玻璃棒;
(3)反应②是Al与NaOH溶液反应,离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(4)反应③是硫酸亚铁与NaOH溶液反应,发生时观察到的现象是:先产生白色沉淀,之后迅速变成灰绿色最后变为红褐色,故答案为:先产生白色沉淀,之后迅速变成灰绿色最后变为红褐色;
(5)过量的氯化氢会使生成的氢氧化铝溶解,反应④中的CO2不宜换成HCl,故答案为:过量的氯化氢会使生成的氢氧化铝溶解;(6)铁粉与铁离子、氢离子反应。氢气的物质的量为:![]() =0.1mol,
=0.1mol,
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为![]() ×(0.16L×5mol/L﹣0.2mol)=0.2mol,
×(0.16L×5mol/L﹣0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为:(0.1mol+0.1mol)×56g/mol=11.2g,故答案为:11.2g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
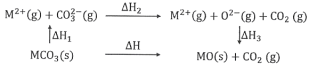
下列说法正确的是
A.△H1(CaCO3)>△H1(MgCO3)>0
B.△H2(MgCO3)>△H2(CaCO3)>0
C.△H1(CaCO3)-△H1(MgCO3)=△H3(CaO)-△H3(MgO)
D.对于MgCO3和CaCO3,△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是____________ (用元素符号表示)。
(2)Z在元素周期表中的位置为____________,M2Z的电子式为____________。
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是__________(写化学式)。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是____________ (写名称)。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为_________________________________
(6)常温下,不能与G的单质发生反应的是____________ (填标号)。
a.CuSO4溶液 b.浓硫酸 c.NaOH溶液 d.浓硝酸 e.氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:
Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中正确的是
A.该反应的氧化剂与还原剂物质的量之比为2:1
B.Cu2S 在反应中只做还原剂
C.Cu 是氧化产物,SO2是还原产物
D.每生成38.4gCu,反应中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL的稀硝酸中加入由铜和镁组成的2.64g 混合物,两者恰好反应固体完全溶解时收集到0.896L(标准状态)NO气体。向反应后的溶液中加入60mLNaOH溶液中金属离子恰好沉淀完全。下列说法正确的是( )
A.原硝酸溶液的物质的量浓度为1.2mol/L
B.形成的沉淀的质量为4.32g
C.混合物中Cu的质量为1.92g
D.NaOH溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸锌晶体是一种微溶于水的白色粉末,可用于制纳米氧化锌、照相乳剂等。以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料生产草酸锌晶体(ZnC2O4·2H2O)的流程如下:
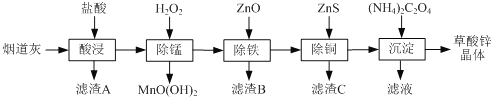
下列说法不正确的是( )
A.滤渣A、滤渣B的主要成分分别为SiO2和Fe(OH)3
B.“除锰”时发生的离子反应为Mn2++H2O2+H2O=MnO(OH)2↓+2H+
C.流程中“除铁”与“除铜”顺序可以颠倒
D.“合成”时过滤所得滤液主要溶质为NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.等物质的量的FeCl2与FeCl3,前者比后者少NA个氯离子
B.16g CH4和18g NH3所含质子数均为10NA
C.1mol过氧化钠与足量水反应时,转移电子的数目为2NA
D.常温常压下,相同体积的Cl2、HCl含有的分子数和原子数均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 | T1 | T2 |
水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25℃<T1<T2,则a__________1×10-14(填“>”、“<”或“=”),做此判断的理由是______________________________________。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
(3)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是____________________________。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一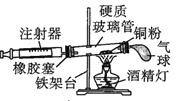 装置二
装置二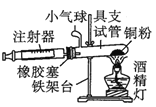
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲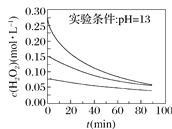 图乙
图乙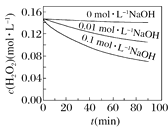
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com