
【题目】(1)甲醚(CH3OCH3)是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,写出甲醚燃烧的热化学方程式_____;已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=______;
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________ kJ。
(3)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,则表示C6H6燃烧热的热化学方程式为_______________________________________。
【答案】CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol ﹣378.8kJ/mol 1.6NA 173.4 C6H6(l)+15/2O2(g)===6CO2(g)+3H2O(l) ΔH=-3 260.4 kJ·mol-1
【解析】
本题考查热化学反应方程式的书写。根据燃烧热的概念1mol可燃物完全燃烧生成稳定氧化物所放出的热量。注意标出物质的状态。
(1)甲醚的燃烧热为1455kJ/mol ,则燃烧方式的热化学方程式为: CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O △H1=﹣1455kJ/mol 。已知H2(g)和C(s)的燃烧热分别是285.8kJmol-1、393.5kJmol-1;①H2(g)+1/2O2(g)=H2O △H=-285.8kJmol-1②C(s)+O2(g)=CO2(g) △H=-393.5kJmol﹣1
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H1=﹣1455kJ/mol;根据盖斯定律计算①![]() 6+②
6+②![]() 2-③
2-③![]() ,计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=(-285.8
,计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=(-285.8![]() 6-393.5
6-393.5![]() 4)-(-1455
4)-(-1455![]() 2)=﹣378.8kJ/mol;因此,本题正确答案是: CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;﹣378.8kJ/mol ;
2)=﹣378.8kJ/mol;因此,本题正确答案是: CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;﹣378.8kJ/mol ;
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
(2)由(①+ ②)/2得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),ΔH =-(574+1160)/2=kJ![]() mol-1=-867 kJ
mol-1=-867 kJ![]() mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol
mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol![]() 8NA=1.6 NA放出的热量为0.2
8NA=1.6 NA放出的热量为0.2![]() =173.4kJ因此,本题正确答案是: 1.6NA、 173.4。
=173.4kJ因此,本题正确答案是: 1.6NA、 173.4。
(3) 燃烧热是指1mol可燃物完全燃烧,生成稳定的氧化物时所放出的热量。1C6H6完全燃烧放热41.8kJ,则1mol C6H6完全燃烧放热41.8 ![]() 78g/mol=3260.4 kJ ,故表示C6H6燃烧热的热化学方程式为C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l)ΔH=-3 260.4 kJ·mol-1。答案:C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l) ΔH=-3 260.4 kJ·mol-1
78g/mol=3260.4 kJ ,故表示C6H6燃烧热的热化学方程式为C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l)ΔH=-3 260.4 kJ·mol-1。答案:C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l) ΔH=-3 260.4 kJ·mol-1


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。回答下列问题:

(1)步骤1关闭K2、K3,打开K1,制备NaClO;步骤2关闭______,打开_______,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4H2O。
(2)盛放碱石灰的仪器的名称为____________,碱石灰的作用_________________。
(3)步骤2中通入N2一段时间的原因是______________________。
(4)本装置中制备氨气的化学方程式是____________________________。
(5)NH3与NaClO反应生成N2H4H2O的化学方程式为______________________。
(6)已知:N2H4H2O+2I2=N2↑+4HI+H2O,实验室用碘标准溶液测定N2H4H2O粗产品的纯度。若称取N2H4H2O粗产品(其它杂质不与I2反应)2.000g,加水配成250.00mL溶液,移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液,用0.3000molL-1的碘标准溶液进行滴定,碘标准溶液盛放在______(填“酸式”或“碱式”)滴定管中。达到终点的现象是___________。实验测得消耗碘标准溶液的平均体积为20.00mL,则粗产品中水合肼的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类,如下所示:
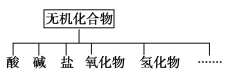
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出实验室由⑩制备O2的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B. 标准状况下,11.2L苯中含有分子的数目为0.5NA
C. 2L0.5mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
D. 标准状况下,22.4L氨水含有NA个NH3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的路线如图:

已知:I.氯代烃D的相对分子质量是113,氯的质量分数约为62.8%,核磁共振氢谱峰面积之比为2︰1;
Ⅱ.
(1)A的顺式异构体的结构简式为___________。D的系统名称是___________。
(2)反应②的条件是___________,依次写出①和③的反应类型:___________、___________。
(3)写出F→G过程中第一步反应的化学方程式:_________________________________。
(4)G还能与其他醇类发生反应,写出G与乙二醇发生聚合反应的化学方程式:________。
(5)写出比G多2个碳原子的同系物的所有同分异构体的结构简式:___________。
(6)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B__。合成路线流程图示如:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
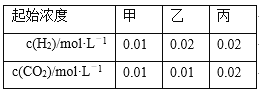
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D. 平衡时,乙中CO2的转化率大于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物结构、性质相关的叙述错误的是
A. 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B. 乙醇分子中含有羟基,能发生氧化反应、取代反应、加成反应。
C. 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D. 乙烯和苯都能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于放热反应的是( )
①盐酸与氢氧化钠溶液反应
②铝片与稀盐酸反应
③Ba(OH)2·8H2O晶体与NH4Cl晶体反应
④天然气的燃烧
A.①②③B.①②④C.①③④D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com