
【题目】电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )
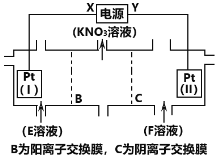
A.X为负极,F溶液为NaNO3溶液
B.电解一段时间,往Pt(I)附近滴入酚酞,溶液变红
C.电解的总反应为2H2O![]() 2H2↑ + O2↑
2H2↑ + O2↑
D.理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体
【答案】D
【解析】
电解KCl和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出口,结合B为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极上氯离子放电,阳极为氢离子放电,氯离子在阳极Pt片(I)上发生氧化反应失去电子生成氯气,氢离子在阴极Pt片(Ⅱ)上得到电子发生还原反应生成氢气,据此分析解答。
A.由上述分析可知E为氯化钾溶液,氯离子在阳极Pt片(I)发生氧化反应,Pt片(I)为阳极,则X为正极,故A错误;
B.氯离子在Pt片(I)发生氧化反应生成氯气逸出,水电离产生的氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,则Pt片(Ⅱ)附近氢氧根离子浓度大于氢离子浓度,显碱性,加入酚酞溶液显红色,故B错误;
C.阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,电解方程式为:H2O+2KCl![]() 2KOH+H2↑+Cl2↑,故C错误;
2KOH+H2↑+Cl2↑,故C错误;
D.当得到0.1molKNO3时,则有0.1mol钾离子透过阳离子交换膜,则转移0.1mol电子,阳极电极反应式:2Cl--2e-=Cl2↑,转移0.1mol电子生成0.05mol氯气,标况下体积为0.05mol×22.4L/mol=1.12L,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
)可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
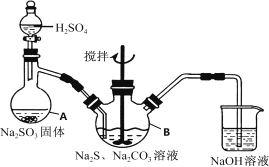
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的![]() 气体较均匀地通入
气体较均匀地通入![]() 和
和![]() 的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的![]() 接近7时,停止通入
接近7时,停止通入![]() 气体。
气体。
③趁热过滤,将滤液加热浓缩,冷却析出![]() 。
。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)仪器A的名称是_________。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液![]() ,请用离子方程式表示原因_________。
,请用离子方程式表示原因_________。
(3)写出三颈烧瓶B中制取![]() 反应的总化学反应方程式_________。
反应的总化学反应方程式_________。
(4)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:
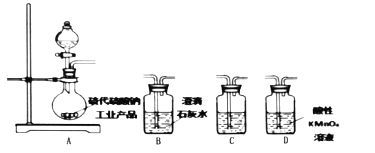
①实验装置的连接顺序依次_________(填装置的字母代号,各装置限用一次),装置C中的试剂为_________。
②能证明固体中含有碳酸钠的实验现象是_________。
③若要检验固体硫代硫酸钠工业产品中含有![]() ,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
(5)![]() 常用作脱氯剂,在溶液中易被
常用作脱氯剂,在溶液中易被![]() 氧化成
氧化成![]() ,该反应的离子方程式为_________。
,该反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
诺氟沙星为喹诺酮类抗生素,其合成路线如下:
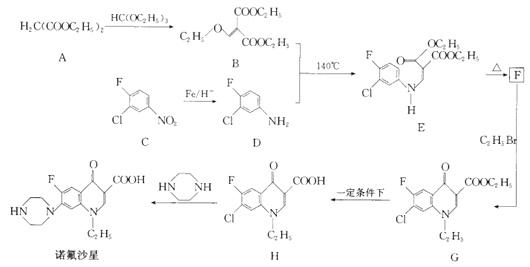
回答下列问题:
(1)化合物A的名称是____________。
(2)诺氟沙星分子中含氧官能团的名称为____________。
(3)C生成D,H生成诺氟沙星的反应类型分别是___________、___________。
(4)F的结构简式为_______________。
(5)G生成H的化学方程式为__________________。
(6)有机物X比B分子少一个CH2原子团,且含有酯基和![]() 结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
(7)参照上述合成路线写出由有机物![]() 、B为有机原料合成
、B为有机原料合成 的路线图______________(无机试剂任选)。
的路线图______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在航空航天、国防工业等领域有广泛应用。某小组利用某工厂废弃物(主要含MgCO3、MgSiO3、Al2O3和Fe2O3)设计回收镁的工艺流程如下:
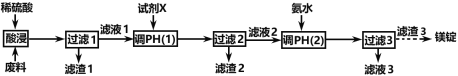
(1)酸浸过程中采用“粉碎废料、加热和搅拌、适当提高稀硫酸的浓度”等措施的目的是_________________________。
为了提高产品纯度,试剂X宜选择(________________)(填代号)。
A.CuO B.MgO C.MgCO3 D.氨水
(2)滤渣1的主要成分是____________:滤渣2的主要成分是____________(填化学式)。
(3)写出生成滤渣3的离子方程式_____________________。
(4)已知:298K,时,Ksp[Al(OH)3]=3.0 × 10-34, Ksp[Fe(OH)3]=4.0 × 10-38,加入试剂X,当Al3+开始沉淀时,溶液中c(Al3+)∕c(Fe3+)=________________。
(5)若废料中镁元素的质量分数为a% ,利用mkg这种废料按上述流程生产,最终回收到质量分数为b%的镁锭wkg,则它的产率为________% 。
(6)参照海水提镁的某些步骤和上述流程图,设计经三步由滤渣3得到镁锭的路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
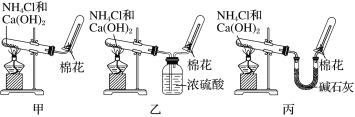
(1)制取氨气的化学方程式为_________________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_________________________________________。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是________(填“甲”、“乙”或“丙”)。
(4)检验氨气是否收集满的方法是___________(简述操作方法、现象和结论)。
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为哪位同学能够达到实验目的________(填“甲”、“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为________(填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
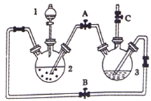
(1)稀硫酸应放在___(填写仪器名称)中。
(2)本实验通过关闭开关___、打开开关___,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___。
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为___。滴定终点的现象是___。
通过实验数据计算的该产品纯度为___(用字母a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“电化学”与人类生产和生活密不可分。
(1)如图为相互串联的甲、乙两个电解池,试回答下列问题。
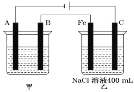
①乙池中若滴入少量酚酞,开始一段时间后,_____电极附近呈红色(填“铁”或“碳”)。
②甲池若为用电解原理精炼铜的装置,A极电极反应式为_____。
③甲池若为用电解原理精炼铜的装置,阴极增重12.8g时,则乙池阳极放出气体在标准状况下的体积为_____(不考虑气体溶解情况)。
(2)人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
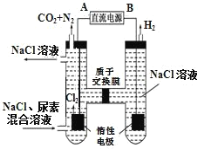
①阳极反应生成的氯气将尿素氧化而得以除去,试写出该反应的化学方程式_____。
②若两极共收集到气体13.44L(标况),则除去的尿素质量为_____ g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
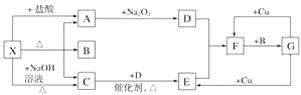
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com