
【题目】I.Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室如何制取Fe(OH)3胶体,请简述操作___,相应的化学方程式是____。
(2)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是____。
(3)除去胶体中混有的FeCl3和HCl的方法是___,如何验证胶体已净化完全,请简述方法___。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为____mol·L-1(保留小数点后一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下面操作造成所配溶液浓度偏高的是___(填序号)。
A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留
B.向容量瓶加水定容时眼睛俯视液面
C.烧杯溶解固体后,用蒸馏水润洗2-3次,将部分洗涤液转入容量瓶中
D.定容摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
【答案】往沸水中逐滴加入饱和FeCl3溶液,继续煮沸至出现红褐色,停止加热即可 FeCl3+3H2O=Fe(OH)3(胶体)+3HCl 硅酸胶粒带负电,使Fe(OH)3胶体聚沉 渗析 取最后一次渗析液,加入AgNO3溶液,若出现白色浑浊,则胶体未净化完全,反之,则净化完全 4.0mol/L 0.04mol/L B
【解析】
I.(1)FeCl3的水溶液滴入沸水中继续煮沸至出现红褐色,停止加热即可得到Fe(OH)3胶体;相应的化学方程式是:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl;
(2)根据胶体发生聚沉的性质进行分析;
(3)胶体的分离和提纯一般采用渗析法;分离的是否完全,可以检验渗析液中是否含有氯离子,选用硝酸和硝酸银试剂进行检验;
Ⅱ.(1)根据c=1000ρω/M进行计算;
(2)原溶液稀释100倍,则稀释后的溶液中c(Na+)是原溶液浓度的1/100;
(3)根据c=n/V进行分析。
I.(1)FeCl3的水溶液滴入沸水中可得到Fe(OH)3胶体,具体操作如下:往沸水中逐滴加入饱和FeCl3溶液,继续煮沸至出现红褐色,停止加热即可;相应的化学方程式是:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl;
故答案是:往沸水中逐滴加入饱和FeCl3溶液,继续煮沸至出现红褐色,停止加热即可;FeCl3+3H2O=Fe(OH)3(胶体)+3HCl;
(2)两种胶粒带有相反电荷的胶体混合时,胶体能发生聚沉,硅酸胶粒带负电,Fe(OH)3胶粒带正电,二者混合后,使Fe(OH)3胶体发生聚沉,因此向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀;
故答案是:硅酸胶粒带负电,使Fe(OH)3胶体聚沉;
(3)溶液中的粒子能够透过半透膜,而胶体粒子不能透过半透膜,因此可以采用渗析的方法进行分离;分离的是否完全,可以检验渗析液中是否含有氯离子,具体操作如下:取最后一次渗析液,加入AgNO3溶液,若出现白色浑浊,则胶体未净化完全,反之,则净化完全;
故答案是:渗析;取最后一次渗析液,加入AgNO3溶液,若出现白色浑浊,则胶体未净化完全,反之,则净化完全;
Ⅱ.(1)根据c=1000ρω/M可知,c=1000×1.19×25%/74.5=4.0mol/L;
故答案是:4.0mol/L;
(2)把原溶液稀释100倍,则稀释后的溶液中c(Na+)=4.0mol/L× 1/100=0.04 mol/L;
故答案是:0.04mol/L;
(3)A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留,不影响溶质的量和溶液的体积,对所配溶液的浓度无影响;
B.向容量瓶加水定容时眼睛俯视液面,造成溶液体积偏小,所配溶液的浓度偏高;
C.烧杯溶解固体后,用蒸馏水润洗2-3次,将部分洗涤液转入容量瓶中,造成溶质的量偏小,所配溶液的浓度偏低;
D.定容摇匀后发现液面低于刻度线,又加蒸馏水至刻度线,造成溶液的体积偏大,所配溶液的浓度偏小;
故答案选B。


科目:高中化学 来源: 题型:
【题目】将一定量Fe、FeO 和Fe2O3的混合物加入240mL2mol·L-1稀硝酸中,恰好完全反应,放出1.344L(标准状况下)NO 气体,往所得溶液中加入酸性KMnO4溶液,无明显现象。若用足量的H2在加热条件下与相同质量的上述混合物充分反应,能得到铁的质量为
A.6.72gB.7.84gC.8.96gD.13.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容的容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥混合气体总质量⑦混合气体总体积.
A. ①②③④⑤⑥⑦ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某校回收的含银悬浊废水中含有AgCl、Ag(NH3)2NO3、AgNO3、CH3COONH4、NaCl等,设计从废水中回收硝酸银的具体流程如下:
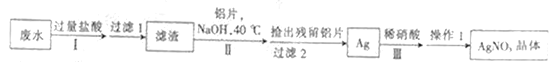
下列说法不正确的是
A. 步骤Ⅱ中发生的主要反应的离子方程:3AgCl+Al+4OH-=3Ag+AlO2-+3Cl-+2H2O
B. 实验中用铝粉代替铝片可以加快反应速率并简化实验操作
C. 步骤Ⅲ中若先将Ag氧化为Ag2O,再加入稀硝酸反应有利于环保
D. 操作Ⅰ包括蒸发浓缩、冷却结晶、过滤、洗涤等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是 ( )
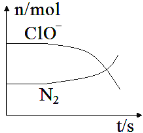
A. 该反应中Cl-为还原产物
B. 氧化剂与还原剂物质的量比为3:2
C. 消耗1 mol还原剂,转移6 mol电子
D. 氧化性:ClO-比 N2强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子物质的量浓度与 100 mL 1 mol·L-1 的 AlCl3 溶液中氯离子物质的量浓度相等的是
A.200 mL 1 mol·L-1 的 NaClB.200 mL 2 mol·L-1 的NH4Cl
C.100 mL 3 mol·L-1 的 KClD.100 mL 2 mol·L-1 的BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是某种药物的中间体,其结构简式为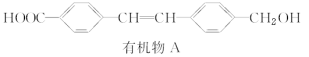 ,关于有机物A的说法正确的是( )
,关于有机物A的说法正确的是( )
A.A的分子式为C16H16O3
B.A可使酸性KMnO4溶液褪色,不可使溴水褪色
C.A苯环上的一氯代物同分异构体有2种
D.A既可发生氧化反应,又可发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B.排水量气,左右液面相平后,未冷却到室温立即读数,所得气体的体积偏大
C.称取2.3gNaCl固体,砝码放在托盘天平的左边,所称量固体药品质量偏小
D.用量筒量取5.0mL浓硫酸,仰视读数,所得到浓硫酸的体积偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A. 混合气体的密度
B. 混合气体的压强
C. 混合气体的总物质的量
D. 混合气体的平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com