
【题目】将一定量Fe、FeO 和Fe2O3的混合物加入240mL2mol·L-1稀硝酸中,恰好完全反应,放出1.344L(标准状况下)NO 气体,往所得溶液中加入酸性KMnO4溶液,无明显现象。若用足量的H2在加热条件下与相同质量的上述混合物充分反应,能得到铁的质量为
A.6.72gB.7.84gC.8.96gD.13.4g
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO3分解反应为2SO3(g)2SO2(g)+O2(g)。在1.0L密闭容器中加入10mol SO3(g),在一定温度进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/kPa | 400 | 412 | 422 | 440 | 469 | 518 | 538 | 560 | 560 |
回答下列问题:
(1)欲提高SO3的平衡转化率,应采取的措施为_____(填字母)。
a.增大压强 b.通入SO3 c.降低压强
(2)平衡时SO3的转化率为_____,该温度下的平衡常数Kw=_____
(3)研究表明,SO3(g)分解速率v=4×10﹣3×pSO3(kPamin﹣1),t=6h时,测得体系中pO2=55kPa,则此时的pSO3=_____kPa,v(SO3)=_____kPamin﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三苯甲醇是有机合成中间体。实验室用格氏试剂![]() )与二苯酮反应制备三苯甲醇。已知:①格氏试剂非常活泼,易与水、氧气、二氧化碳等物质反应;
)与二苯酮反应制备三苯甲醇。已知:①格氏试剂非常活泼,易与水、氧气、二氧化碳等物质反应;
②![]()
③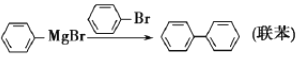
④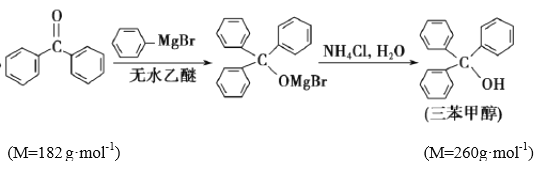
实验过程如下
①实验装置如图1所示。
a.合成格氏试剂:向三颈烧瓶中加入0.75g镁屑和少量碘(引发剂),连接好装置,在恒压漏斗中加入3.20mL(0.03mol)溴苯和15.00mL乙醚混匀,开始缓慢滴加混合液,滴完后待用。
b.制备三苯甲醇:将5.50g二苯与15.00mL乙醚在恒压漏斗中混匀,滴入三颈烧瓶。40℃左右水溶回流0.5h,加入20.00mL包和氯化铵溶液,使晶体析出。
②提纯:图2是简易水蒸气蒸馏装置,用该装置进行提纯,最后冷却抽滤
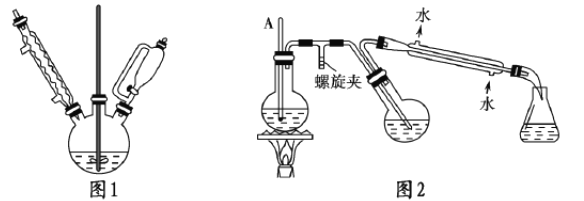
(1)图1实验中,实验装置有缺陷,应在球形冷凝管上连接____________装置
(2)①合成格氏试剂过程中,低沸点乙醚的作用是____________________;
②合成格氏试剂过程中,如果混合液滴加过快将导致格氏试剂产率下降,其原因是______;
(3)提纯过程中发现A中液面上升,此时应立即进行的操作是_______;
(4)①反应结束后获得三苯甲醇晶体的操作为_______、过滤、洗涤______;
A.蒸发结晶 B.冷却结晶 C.高温烘干 D.滤纸吸干
②下列抽滤操作或说法正确的是_______
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状成剧粒太小的沉淀
(5)用移液管量取20.00mL饱和氯化较溶液,吸取液体时,左手______,右手持移液管;
(6)通过称量得到产物4.00g,则本实验产率为__________(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
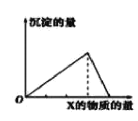
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
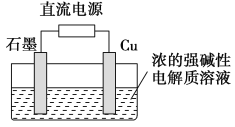
A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室中常用排饱和食盐水的方法收集Cl2
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加少量铁粉,振荡静置,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室如何制取Fe(OH)3胶体,请简述操作___,相应的化学方程式是____。
(2)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是____。
(3)除去胶体中混有的FeCl3和HCl的方法是___,如何验证胶体已净化完全,请简述方法___。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为____mol·L-1(保留小数点后一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下面操作造成所配溶液浓度偏高的是___(填序号)。
A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留
B.向容量瓶加水定容时眼睛俯视液面
C.烧杯溶解固体后,用蒸馏水润洗2-3次,将部分洗涤液转入容量瓶中
D.定容摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com