
����Ŀ��A��B��C��D��E��F��Ϊ���ڱ���ǰ�����ڵ�Ԫ�ء��밴Ҫ��ش��������⡣
��1����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
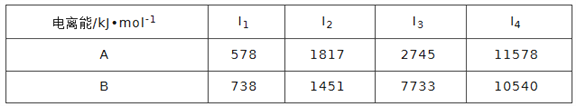
�����й�A��B����������ȷ���ǣ�____��a.���Ӱ뾶A<B b.�縺��A<B
c.���ʵ��۵�A>B d.A��B�ĵ��ʾ�������������û�
e.A��������������� f.A��B��������Ԫ�ع������Ӿ���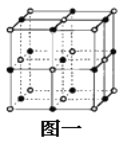
��2��C�ǵؿ��к�����ߵ�Ԫ�أ�C��̬ԭ�ӵĵ����Ų�ʽΪ_______��Cn-��D2+��l�����Ӳ㡣���߹��ɵľ���Ľṹ��NaCl����ṹ���ƣ���ͼһ��ʾ����������һ��D2+��Χ�������ڽ��ҵȾ����D2+��_____����
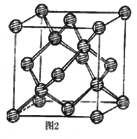
��3��EԪ��ԭ�ӵ��������������������������2���������������Eԭ�ӵ��ӻ���ʽ��_____��E��һ�ֵ������пռ���״�ṹ�������ṹ��ͼ2����֪λ�ھ����ڲ���4��ԭ�ӣ���λ����Խ��ߵ�1/4��3/4����E-E����Ϊapm����E������ܶ�Ϊ_________g/cm3(�ú���NA��a��ʽ�ӱ�ʾ����
��4��F����Ԫ��ͬ���ڣ�Fλ��p����δ�ɶԵ�������Ԫ�����У�F�ļ۵����Ų�ͼΪ
______��FO33-���ӵĿռ乹��Ϊ__________��F��һ������_______��Ԫ�أ��������<��)
���𰸡�bf1s22s22p412sp2 sp3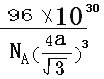 ��
��![]()
![]() �����ͣ�
�����ͣ�
��������(1)���ݱ��е����ݿ����жϳ�AΪ����A���Ԫ�أ�BΪ����A���Ԫ�أ����ڶ��ǵ������ڣ�����AΪ��Ԫ�أ�BΪþԪ�أ������ӵİ뾶С��þ���ӣ���Ԫ�صĵ縺�Դ���þԪ�أ������۵����þ�������Է������ȷ���þ���ԺͶ�����̼��Ӧ����̼��������Ϊ����������Ȼ���Ϊ���Ӿ��壬�ʴ�Ϊ��bf��
(2)�ؿ��к�����ߵ�Ԫ��Ϊ��Ԫ�أ���̬�����Ų�ʽΪ1s22s22p4��O2-��D2+��1�����Ӳ㣬��DΪ��Ԫ�أ��γɵľ���ΪCaO����NaCl����ṹ���ƣ��Ծ��������ϵĸ�����Ϊ������������Ӿ�������ĸ����ӷֲ��ھ�����ߵ��е㣬����Ϊ��Խ��ߵ�һ�룬������������12�����ʴ�Ϊ��1s22s22p4��12��
(3)EԪ��ԭ�ӵ��������������������������2������EΪ̼ԭ�ӣ�����������м���Cԭ����Χ���ǵ�����������û�йµ��Ӷԣ�����C���ӻ���ʽ��sp3�ӻ������Ȼ���Cԭ�Ӻ���̼��˫��������C���ӻ���ʽ��sp2�ӻ�����C���ʵľ�������Խ��߳���ΪC-C������4�������Ծ����ı߳�Ϊ4��![]() apm�����Ծ��������Ϊ64��
apm�����Ծ��������Ϊ64��![]() a3��1030cm���ھ����к��е�ԭ����Ϊ4+8��
a3��1030cm���ھ����к��е�ԭ����Ϊ4+8��![]() +6��
+6��![]() =8���ٸ�������
=8���ٸ�������![]() ��֪���ܶ�Ϊ
��֪���ܶ�Ϊ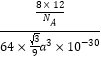 g/cm3=
g/cm3=![]() g/cm3���ʴ�Ϊ��sp2��sp3��
g/cm3���ʴ�Ϊ��sp2��sp3��![]() ��
��
(4)F����Ԫ��ͬ���ڣ����ڵ������ڣ�Fλ��p����δ�ɶԵ�������Ԫ�����У���Ϊ�������壬����Fԭ�ӵļ۵����Ų�ͼΪ![]() ��FΪAsԪ�أ�AsO33-������Asԭ�ӵļ۵��Ӷ���Ϊ
��FΪAsԪ�أ�AsO33-������Asԭ�ӵļ۵��Ӷ���Ϊ![]() =4��������������As-O����һ�Թµ��Ӷԣ�����AsO33-�Ŀռ乹��Ϊ�����Σ�ͬ����Ԫ�أ�����ԭ������������һ������Ҳ����AsԪ�ص�p����3�����ӣ������״̬������As�ĵ�һ�����ܴ���Se���ʴ�Ϊ��
=4��������������As-O����һ�Թµ��Ӷԣ�����AsO33-�Ŀռ乹��Ϊ�����Σ�ͬ����Ԫ�أ�����ԭ������������һ������Ҳ����AsԪ�ص�p����3�����ӣ������״̬������As�ĵ�һ�����ܴ���Se���ʴ�Ϊ��![]() �������Σ�����
������������


 С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ���ǣ� ��
A.����ϡ����ķ�Ӧ
B.���ȵ�ľ̿��CO2��Ӧ
C.�����������е�ȼ�շ�Ӧ
D.Ba��OH��28H2O������NH4Cl����ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и��������£����뷽��ʽ��д��ȷ����
A������״̬�µ�NaHSO4���룺NaHSO4===Na����H����SO![]()
B��H2CO3�ĵ��룺H2CO3![]() 2H����CO
2H����CO![]()
C��Fe(OH)3�ĵ��룺Fe(OH)3===Fe3����3OH��
D��ˮ��Һ�е�NaHSO3���룺NaHSO3===Na����HSO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2017��������ģ��������������ƿ��������©��������Һ©�������ζ��ܣ�ʹ��ǰ����Ҫ����Ƿ�©Һ����( )
A��ȫ�� B���٢ۢ� C��ֻ�������� D��ֻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ũ��������������������棬����Ϊ�������Ũ�����з�����_______________�������ڼ��������£�Ũ���ỹ�ǿ��Ժ�����Ӧ�ġ�
д�����ڼ��������º�����Ũ���ᷴӦ�Ļ�ѧ����ʽ�����������ת�Ʒ�������Ŀ____________________________________________________��
������Ӧ��________Ԫ�ر���ԭ����ԭ������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͷ���Ľṹ��ʽΪCH3��CH=CH��COOH�����Т��Ȼ��⡢����ˮ���۴�����Һ�����Ҵ��������Ը��������Һ���ж���һ�������£�����Ͷ��ᷴӦ�������ǣ� ��
A.ֻ�Тڢܢ�
B.ֻ�Т٢ۢ�
C.ֻ�Т٢ڢۢ�
D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ����X��Y��Ϊʯī�缫�����ҺΪ500mLij��ɫ��Һ�����һ��ʱ�䣬�۲쵽X �缫�����к�ɫ�Ĺ�̬�������ɣ�Y �缫����ɫ�������ɣ���Һ��ԭ��������ȫ����ֹͣ��⣬ȡ��X�缫�� ϴ�ӡ�����������缫����1.6g�������й�˵���д�����ǣ� ��
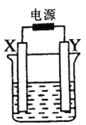
A. X�缫������
B. Y�缫������������Ϊ0.224L
C. ������Һ��pH=1
D. Ҫʹ������Һ�ָ������ǰ��״̬�������һ�����CuO ��CuCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ȫ����������ʵ���
A��H2O��NH3��H2O��H3PO4��HF B��Cu(OH)2��CH3COOH��C2H5OH��CH3COONa
C��H2SO3��Ba(OH)2��BaSO4 D��SO2��H2S��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҽ����������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������
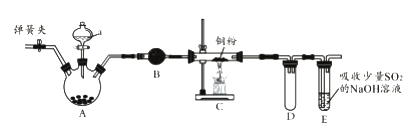
��1��A�й���������أ�Һ��a��Ũ���ᣬд���÷�Ӧ�Ļ�ѧ����ʽ��_________________��
��2��BΪ����װ�ã�����Ĺ�����_________________��������������A��B��Ӧ����һ��ʢ��_________________��ϴ��ƿ��
��3��C�еķ�Ӧ������_________________��D��������_________________��
��4����֪E�з����ķ�ӦΪ��Cl2+Na2SO3+2NaOH![]() 2NaCl+Na2SO4+H2O��E������β��һ��ʱ�������Һ��ǿ���ԣ��п϶����ڣ�Cl-��OH-��SO42-��ij��ȤС����Ϊ������Һ�л����ܴ���ClO-��SO32-��
2NaCl+Na2SO4+H2O��E������β��һ��ʱ�������Һ��ǿ���ԣ��п϶����ڣ�Cl-��OH-��SO42-��ij��ȤС����Ϊ������Һ�л����ܴ���ClO-��SO32-��
a����ͬѧ��Ϊ������Һ��ClO-��SO32-����ͬʱ���ڣ���������_________________�������ӷ���ʽ��ʾ����
b����ͬѧΪ�˼�������Һ���Ƿ���SO32-��ȡ��������Һ���Թ��У�������ϡ�����ữ�μ�Ʒ����Һ������Ʒ����Һ��ɫ���ݴ��ƶϸ�����Һ��һ����SO32-����ͬѧ���ƶ��Ƿ���ȷ��________________�����ȷ������ȷ������������_________________��
c�������ʵ���������Һ���Ƿ���ClO-_______________��д��ʵ�鲽�衢����ͽ��ۣ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com