
【题目】科学家近期研发出如图所示的水溶液锂离子电池体系,下列有关叙述错误的是
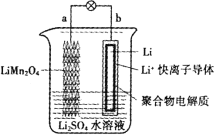
A.b电极不可用石墨替代Li
B.正极反应为:Li1-xMn2O4+xLi++xe- = LiMn2O4
C.电池总反应为:Li1-xMn2O4+xLi = LiMn2O4
D.放电时,溶液中Li+从a向b迁移
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】三种常见元素结构信息如下表,试根据信息回答有关问题:

(1)写出B原子的基态电子排布式__;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键__(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角__(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__,简要描述该配合物中化学键的成键情况__;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是__(填写序号);在②的分子中有__个σ键和__个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含N、S的污染排放物并妥善处理和利用,意义重大。回答下列问题:
(1)![]() 尾气先用氨水吸收生成
尾气先用氨水吸收生成![]() ,反应为
,反应为![]()
![]() ,再将
,再将![]() 氧化为
氧化为![]() ,最终实现副产氮肥,变废为宝。两种氧化方案如下:
,最终实现副产氮肥,变废为宝。两种氧化方案如下:
方案1:![]()
方案2:![]() ,
,
![]() 。
。
30℃时,分别向两相同容器中加入100L 0.4![]() 溶液,加入足量相同物质的量的氧化剂,测得
溶液,加入足量相同物质的量的氧化剂,测得![]() 的氧化率X(%)随时间的变化如图所示。
的氧化率X(%)随时间的变化如图所示。
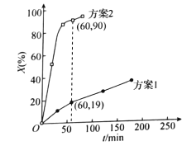
据上述图像判断,氧化![]() 为
为![]() 的能力是
的能力是![]() ____(填“大于”或“小于”)
____(填“大于”或“小于”)![]() ,可能的原因是___。
,可能的原因是___。
②60min内测得方案2体系中用![]() 表示的反应速率为__
表示的反应速率为__![]() 。
。
(2)方案2中,![]() 会被氧化成
会被氧化成![]() ,而
,而![]() 不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加
不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加![]() 将
将![]() 还原成
还原成![]() ,同时生成
,同时生成![]() 。反应历程如下:
。反应历程如下:
i:![]()
ii:_____
iii:![]()
iv:![]()
则第ii步反应为____。
(3)利用废气中的![]() 将(2)中生成的
将(2)中生成的![]() 还原成
还原成![]() ,以实现
,以实现![]() 再生。反应的离子方程式为____。
再生。反应的离子方程式为____。
![]() 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化![]() 为
为![]() 的过程,则整个过程中起催化剂作用的是___(填离子符号)。
的过程,则整个过程中起催化剂作用的是___(填离子符号)。
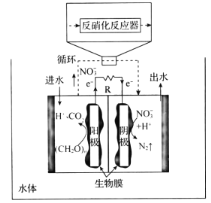
(4)关于微生物电化学系统处理含氮废水的研究快速发展,如图是一种新型的浸没式双极室脱盐-反硝化电池。由阳极室和阴极室组成,中间由质子交换膜隔开,阳极室中的有机物则被微生物氧化降解产生电子和质子,其中的![]() 通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成
通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成![]() 。
。
①微生物电化学系统处理有机含氮废水的优点是____。
②写出负极发生反应的电极反应式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2- =2Fe2++S↓
B. 将Na2O2固体投入H218O中:2Na2O2+2H218O =4Na++4OH-+18O2↑
C. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH- = Al(OH)3↓+NH3·H2O+2BaSO4↓
D. 二氧化锰与浓盐酸反应:MnO2+4H++4Cl- ![]() Mn2++2H2O+2Cl2↑
Mn2++2H2O+2Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】In是第5周期ⅢA的元素;In2O3是一种透明的导电材料,可运用于触控屏、液晶显示器等高科技领域;利用水铟矿(主要成分In(OH)3),制备In2O3的工艺流程如下:
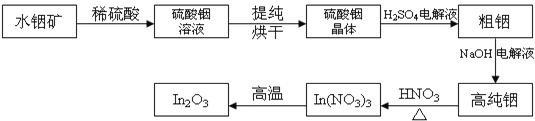
(1)写出水铟矿被硫酸酸溶的离子方程式:_____________________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:___、___、过滤、洗涤和干燥。
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为___(填“阴极”、“阳极”),写出阴极的电极反应式___________________________________。
(4)完成下列化学方程式:___In(NO3)3![]() ___In2O3+___↑+___↑。
___In2O3+___↑+___↑。
(5)高纯铟和浓硝酸反应过程中产生的NO2气体可以被Na2O2直接吸收,则标准状况下672mLNO2可以被___gNa2O2吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
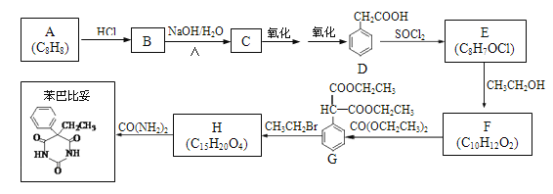
【题目】以A为原料合成安眠药——苯巴比妥的路线如下:
已知:ⅰ.CH3COOH+SOCl2![]()
![]() +SO2+HCl
+SO2+HCl
ⅱ. 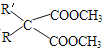 +CO(NH2)2
+CO(NH2)2![]()
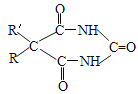 +2CH3OH(R、R为H原子或羟基)
+2CH3OH(R、R为H原子或羟基)
(1)A中官能团的名称是_____。
(2)B→C的化学方程式是_______________________________________。
(3)F为酯,其结构简式是______________________________________。
(4)F→G的反应类型是_________________________________________。
(5)H的结构简式是____________________________________________。
(6)G与CO(NH2)2在一定条件下合成的高分子结构简式是________________。
(7)D的同分异构体有多种,苯环上只有两个取代基且能发生银镜反应的有_____种,写出核磁共振氢谱中氢原子种类数最少的任一种同分异构体的结构简式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素A、B、C、D。A元素M层上电子数是K层的3倍,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
(1)A的离子结构示意图是__________________。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:____________。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,但不能用它干燥H2S气体,其原因是___________(用化学反应的化学方程式表示)
(3)B与C元素形成带一个单位正电荷的离子,写成该微粒的电子式_________。写出实验室检验溶液中该离子的简单实验方案:___________________________。
(4)元素A与元素D相比,非金属性较强的是_________(用元素符号表示),下列表述中能表明这一事实的是_________。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)元素B、C与D组成的化合物固态时属于_______________晶体。
①原子晶体 ②离子晶体 ③分子晶体 ④分子晶体或离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA
B.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA
C.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA
D.标准状况下,11.2L H2O含有0.5NA分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是
A. 该反应的氧化剂只有Cu2O B. Cu既是氧化产物,又是还原产物
C. Cu2S既是氧化剂又是还原剂 D. 还原产物与氧化产物的物质的量之比为1∶6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com