
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是 ______________________。
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色。为测定该实验所得 “铁块”中铁元素含量,设计实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择________,试剂B应选择_______。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式_____________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4。
操作 | 预期现象 |
取少量M固体于试管中,向其中加入________________;观察。 | 固体完全溶解,溶液呈黄色。 |
继续向上述溶液中滴入_________________,振荡观察 | ______________________ |
④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是____________。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
【答案】引发铝热反应 C D 2Fe2+ + H2O2 + 2H+ = 2Fe3++2H2O 足量稀硫酸 几滴(少量)高锰酸钾溶液 溶液紫红色未褪去 连续两次灼烧质量相差不大于0.1g 84.0%
【解析】
(1)铝热反应需要在高温条件下进行,Mg条燃烧,放出热量,使氯酸钾分解产生O2,促使镁条剧烈燃烧,产生更多的热量,达到铝热反应所需要的高温。答案为:引发铝热反应
(2))①由提给信息可知,铁块中含+2价铁,根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,调节pH选用的试剂不能用氧化铁,因为会引起红色粉未M的质量偏大,故应选用氨水,故答案为C;D
② Fe2+具有还原性,能被H2O2在酸性下氧化成Fe3+,2Fe2+ + H2O2 + 2H+ = 2Fe3++2H2O
③ Fe2O3中Fe为+3价,Fe3O4中Fe既有+3价,又有+2价,取少量M固体于试管中,向其中加入足量稀硫酸,发现固体溶解,溶液呈黄色,说明溶液中含Fe3+;再向溶液中加入KMnO4溶液,观察现象,发现溶液紫红色未褪去,说明溶液中无Fe2+,因为Fe2+有还原性,能与酸性KMnO4溶液发生氧化还原反应,而使KMnO4溶液褪色。故答案为足量稀硫酸、几滴(少量)高锰酸钾溶液 、 溶液紫红色未褪去 ;
④ 若Fe(OH)3已完全分解,则用天平连续两次称量M的质量时相差不大于0.1g。故答案为连续两次灼烧质量相差不大于0.1g;
⑤红色粉末为Fe2O3 ,质量为12.0g,物质的量为12/160 =0.075(mol),根据铁守恒有铁块中铁的质量为0.075*56*2=8.4(g),铁块纯度为![]() ×100℅=84℅
×100℅=84℅


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。
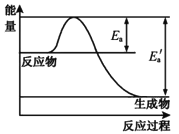
下列说法正确的是( )
A.Ea为逆反应活化能,Ea′为正反应活化能
B.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.该反应为放热反应,ΔH=Ea′-Ea
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为________。
② 若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2﹣二甲基丁烷,则烃A的名称是_______,结构简式是______。
③比烃A少两个碳原子且能使溴水褪色的A的同系物有__种同分异构体
(2)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是_____。
A. CH3﹣CH3 B. CH3COOH C. CH3COOCH3 D. CH3COCH3
(3)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图1所示,则A的结构简式为_______。
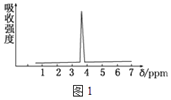
(4)某化合物的结构式(键线式)及球棍模型如图2:该有机分子的核磁共振氢谱图如图3(单位是ppm) 。下列关于该有机物的叙述正确的是_______。

A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香族化合物,且属于酚
C. 键线式中的Et代表的基团为﹣CH3
D. 该有机物在一定条件下能够发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:
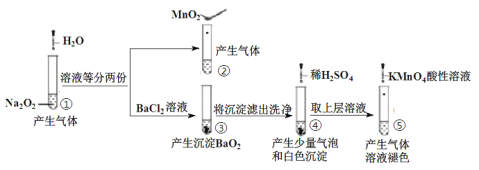
已知:H2O2H++![]() ;
;![]() H++
H++![]() 。下列分析不正确的是
。下列分析不正确的是
A.①、④实验中均发生了氧化还原反应和复分解反应
B.①、⑤中产生的气体能使带火星的木条复燃,说明存在H2O2
C.③和④不能说明溶解性:BaO2> BaSO4
D.⑤中说明H2O2具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
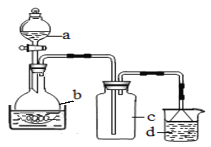
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
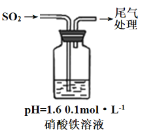
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列气体去除杂质的方法中,不能实现目的的是
气体(杂质) | 方法 | |
A | SO2(H2S) | 通过酸性高锰酸钾溶液 |
B | Cl2(HCl) | 通过饱和的食盐水 |
C | N2(O2) | 通过灼热的铜丝网 |
D | NO(NO2) | 通过氢氧化钠溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机碱,例如二甲基胺(![]() )、苯胺(
)、苯胺(![]() ),吡啶(
),吡啶(![]() )等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
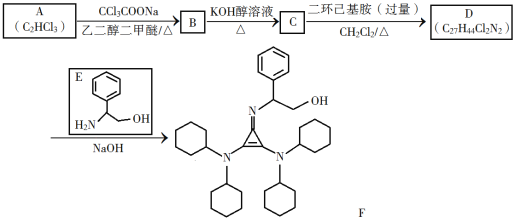
已知如下信息:
①H2C=CH2![]()
![]()
②![]() +RNH2
+RNH2![]()
![]()
③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为________。
(2)由B生成C的化学方程式为________。
(3)C中所含官能团的名称为________。
(4)由C生成D的反应类型为________。
(5)D的结构简式为________。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6∶2∶2∶1的有________种,其中,芳香环上为二取代的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸被用于亚麻织品的漂白、棉织品的酸化和毛织品的染色。吕布兰法的成功,又需大量地从硫酸和食盐制取硫酸钠。迅速增长的需求为初兴的硫酸工业开拓了顺利发展的道路。1874年,天津机械局淋硝厂建成中国最早的铅室法装置,1876年投产,日产硫酸约2t。“接触法制硫酸”的核心反应是: 2SO2 +O2 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
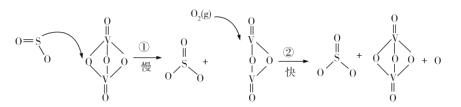
下列说法正确的是
A.反应①的活化能比反应②低
B.总反应的反应速率由反应①决定
C.图示过程中既有 S—O 键的断裂,又有S—O键的形成
D.该反应的催化剂有V2O5和V2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com