
【题目】硫酸被用于亚麻织品的漂白、棉织品的酸化和毛织品的染色。吕布兰法的成功,又需大量地从硫酸和食盐制取硫酸钠。迅速增长的需求为初兴的硫酸工业开拓了顺利发展的道路。1874年,天津机械局淋硝厂建成中国最早的铅室法装置,1876年投产,日产硫酸约2t。“接触法制硫酸”的核心反应是: 2SO2 +O2 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
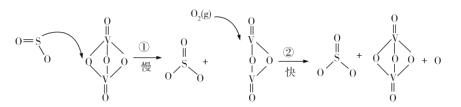
下列说法正确的是
A.反应①的活化能比反应②低
B.总反应的反应速率由反应①决定
C.图示过程中既有 S—O 键的断裂,又有S—O键的形成
D.该反应的催化剂有V2O5和V2O4
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是 ______________________。
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色。为测定该实验所得 “铁块”中铁元素含量,设计实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择________,试剂B应选择_______。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式_____________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4。
操作 | 预期现象 |
取少量M固体于试管中,向其中加入________________;观察。 | 固体完全溶解,溶液呈黄色。 |
继续向上述溶液中滴入_________________,振荡观察 | ______________________ |
④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是____________。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置检验Cl2的性质。
|
|
|
Ⅰ |
| Ⅲ |
(1)I图中退色的是______(填“a”或“b”),I图烧杯中发生反应的离子方程式是______。
(2)Ⅱ图中的现象是_________。
(3)将铜丝换成铁丝,做Ⅱ实验,结果也能点燃,你认为铁丝也能点燃的理由是_______(填选项字母)。
A Fe与Cu都是金属元素 B Fe的熔点比Cu高
C Fe的密度比Cu小 D Fe的性质比Cu活泼
(4)将Ⅲ装置放置在光亮的地方(日光没有直接照射),一会儿后,量筒内黄绿色气体颜色变浅,量筒内液面上升等。(混合气中氢气含量为60%),己知:氢气含量超过52.8%,光照不会发生爆炸)
①量筒中液面上升的原因是_________。
②水槽用饱和食盐水而不用水的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所下列化学用语的理解正确的是( )
A.比例模型![]() 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
B.电子式![]() H既可以表示羟基,也可以表示氢氧根离子
H既可以表示羟基,也可以表示氢氧根离子
C.丙烯的最简式可表示为CH2
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A. 0.02 mol/(Lmin)B. 1.2 mol/(Lmin)
C. 1.8mol/(Lmin)D. 0.18 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少“84”消毒液对物品的腐蚀,天津一中高三师生给教室消毒使用的是二氧化氯泡腾片。二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体 ,其熔点为 -59℃,沸点为11.0℃,易溶于水。是目前国际上公认的新—代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面有广泛应用的高效安全消毒剂。与(Cl2)相比(ClO2)不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
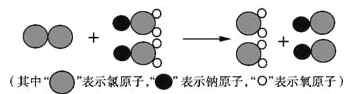
该反应的化学方程式为 ____________。
Ⅰ.ClO2是—种优良的消毒剂 ,浓度过高时易发生分解,为了运输和贮存便利常将其制成NaClO2固体 ,模拟工业上用过氧化氢法制备NaClO2固体的实验装置如图所示:
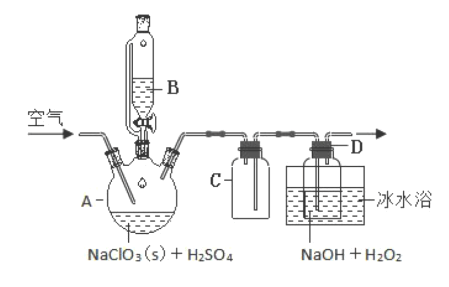
已知:H2O2沸点 150℃;A中的化学方程式:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(2)NaClO3放入仪器 A中,仪器B中的药品是________(写化学式)。
(3)如果仪器B 改成分液漏斗,实验过程中可能会出现的实验现象_______。
(4)向 A 装詈中通入空气,其作用是赶出ClO2然后通过C 再到 D 中反应。通空气不能过快的,空气流速过快时ClO2不能被充分吸收;通空气也不能过慢,其原因是_________。
(5)冰水浴冷却的目的是_____。
a.降低NaClO2的溶解度 b.减少H2O2的分解
c.使ClO2变为液态 d. 加快反应速率
Ⅱ.“稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。
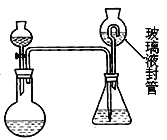
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
(6)为证实“稳定性二氧化氯溶液”中含有钠离子,方法是:______。
(7)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取 mg(2g 左右)试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液 ;②在锥形瓶中加入4g 碘化钾,用 100 mL水溶解后 ,再加 3 mL 硫酸溶液 ;③ 在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmo l/L硫代硫酸钠标准溶液滴定至蓝色消失 (![]() ), 共用去VmL 硫代硫酸钠溶液。
), 共用去VmL 硫代硫酸钠溶液。
①NaClO2与盐酸反应生成ClO2(还原产物为Cl-)该反应的化学方程式为:_______;
②ClO2通入锥形瓶与酸性碘化钾溶液反应,二氧化氯被还原为氯离子,该反应的离子方程式为:_______。
③“稳定性二氧化氯溶液”中,ClO2的质量分数为_____(用m、c、V表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
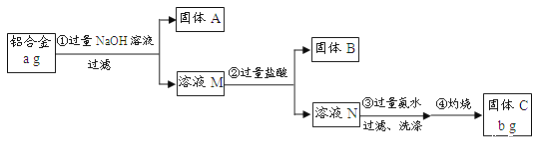
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2。
请回答下列问题:
(1)固体A的成分是_______;
(2)生成固体B的化学方程式为_____;步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______;(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
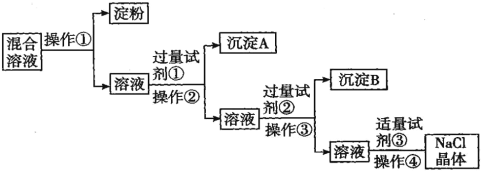
(1)操作①的名称是___________
(2)试剂①的化学式是____________ 判断试剂①已过量的方法是:________________________
(3)加入试剂②发生的离子方程式是____________________________________。
(4)操作④的名称是:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年,中外科学家团队共同合成T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如图。下列说法错误的是( )

A.每个T-碳晶胞中含32个碳原子
B.T-碳中碳与碳的最小夹角为109.5。
C.T-碳属于原子晶体
D.如图是T-碳晶胞的俯视图

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com