
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
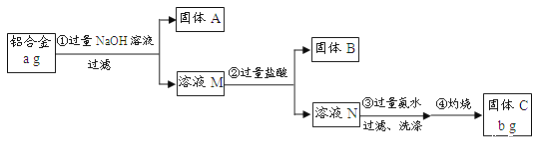
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2。
请回答下列问题:
(1)固体A的成分是_______;
(2)生成固体B的化学方程式为_____;步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______;(用a、b表示)
【答案】MgO、CuO Na2SiO3+2HCl=2NaCl+H2SiO3↓ Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净 ![]() ×100%
×100%
【解析】
该铝合金的主要成分为Al2O3、MgO、CuO、SiO2,加入过量氢氧化钠溶液,只有Al2O3、SiO2与过量的NaOH溶液反应,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,过滤,固体A为MgO、CuO溶液M为NaAlO2、Na2SiO3,溶液M中加入过量盐酸,发生反应的方程式为:Na2SiO3+2HCl=2NaCl+H2SiO3↓,NaAlO2+4HCl(过量)=NaCl+AlCl3+2H2O,所以过滤得到固体B为H2SiO3,溶液N中为AlCl3溶液,加入过量氨水,发生的反应为:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,过滤洗涤得到氢氧化铝沉淀,灼烧得到固体C为Al2O3,据此答题。
(1)根据分析可知:固体A为MgO、CuO,故答案为:。
(2)固体B为硅酸钠和盐酸反应生成硅酸沉淀,反应的化学方程式为:Na2SiO3+2HCl=2NaCl+H2SiO3↓,步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故答案为:Na2SiO3+2HCl=2NaCl+H2SiO3↓,Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(3)沉淀表面沾有氯化铵、氯化钠溶液,检验最后一次洗涤液中是否含有氯离子,设计实验证明:取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净;故答案为:取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净。
(4)由分析分析可知bg固体C为Al2O3,依据铝元素守恒计算,铝的质量分数=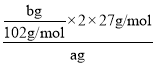 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】现有四种有机物:①乙烯 ②2-丙醇 ③ 甲苯 ④ 乙炔,其中:
(1)能发生消去反应的是_________(填序号,下同),其化学方程式是________。
(2)能衡量一个国家的石油化工生产水平的是__________,该物质可用于一种常用塑料,其反应的化学方程式是__________。
(3)能用来制取梯恩梯(TNT)的是________,其发生反应的化学方程式是________。
(4)碳元素的质量百分含量最高的是________,实验室制取该物质的反应装置如下:
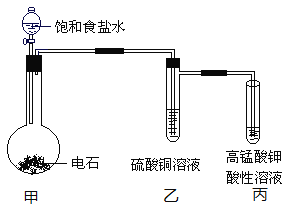
甲中反应的化学方程式是________,滴加饱和食盐水而不直接滴加水的原因是________,乙中硫酸铜溶液的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表结构中的一小部分,甲~戊是短周期元素,下面判断正确的是( )

A. 原子半径:甲<丙<戊
B. 金属性:甲>丙
C. 戊可能是ⅢA族元素
D. 丁最高价氧化物对应的水化物可能是H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是

A. a电极是负极
B. b电极的电极反应为:4OH--4e-====2H2O+O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX = ![]() 或
或![]() 。下列叙述不正确的是
。下列叙述不正确的是

A. 曲线m表示![]() 与pH的变化关系
与pH的变化关系
B. Ka1(H2X)的数量级为10-7
C. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的叙述错误的是
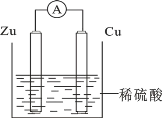
A. 锌是负极,其质量逐渐减小
B. 氢离子在铜表面得e-
C. 电子从锌片经导线流向铜片
D. 电流从锌片经导线流向铜片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com