
【题目】2017年,中外科学家团队共同合成T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如图。下列说法错误的是( )

A.每个T-碳晶胞中含32个碳原子
B.T-碳中碳与碳的最小夹角为109.5。
C.T-碳属于原子晶体
D.如图是T-碳晶胞的俯视图

【答案】B
【解析】
A、一个金刚石晶胞中,含有C的数目为8×1/8+6×1/2+4=8,将每个C原子换成四面体结构的C,则T-碳晶胞中含有碳原子数目为8×4=32个;
B、4个碳原子组成的正四面体结构单元,T-碳中碳与碳的最小夹角为60°;
C、C原子间以共价键结合成空间网状结构;
D、T-碳晶胞的俯视图正确,突出四面体结构,及四面体之间碳与碳的共价键;
A、一个金刚石晶胞中,含有C的数目为8×1/8+6×1/2+4=8,将每个C原子换成四面体结构的C,则T-碳晶胞中含有碳原子数目为8×4=32个,故A正确;
B、4个碳原子组成的正四面体结构单元,T-碳中碳与碳的最小夹角为60°,故B错误;
C、C原子间以共价键结合成空间网状结构,T-碳属于原子晶体,故C正确;
D、T-碳晶胞的俯视图正确,突出了四面体结构,及四面体之间碳与碳的共价键,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】硫酸被用于亚麻织品的漂白、棉织品的酸化和毛织品的染色。吕布兰法的成功,又需大量地从硫酸和食盐制取硫酸钠。迅速增长的需求为初兴的硫酸工业开拓了顺利发展的道路。1874年,天津机械局淋硝厂建成中国最早的铅室法装置,1876年投产,日产硫酸约2t。“接触法制硫酸”的核心反应是: 2SO2 +O2 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
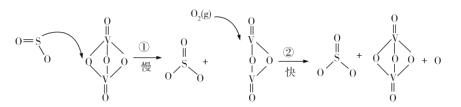
下列说法正确的是
A.反应①的活化能比反应②低
B.总反应的反应速率由反应①决定
C.图示过程中既有 S—O 键的断裂,又有S—O键的形成
D.该反应的催化剂有V2O5和V2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色的配合物,是合成其它一些含钴配合物的原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图,回答下列问题:
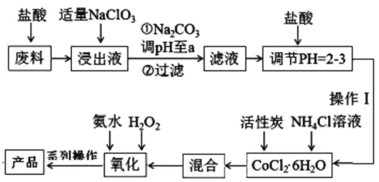
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“适量NaClO3”的作用是___,发生反应的离子方程式为___。
(2)“加Na2CO3调pH至a”会生成两种沉淀,分别为___(填化学式)。
(3)操作Ⅰ的步骤包括___、___、减压过滤。
(4)流程中“氧化”过程应先加入___(填“氨水”或“H2O2”),需水浴控温在50~60℃,温度不能过高,原因是___。写出“氧化”步骤发生反应的离子方程式:___,若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2。使一定量的锌与100mL18.5mol·L-1浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A33.6L。将反应后的溶液稀释到1L,测得溶液中氢离子的浓度为0.1mol·L-1。
(1)写出锌跟浓硫酸反应的化学方程式:____。
(2)反应过程中消耗的H2SO4的物质的量是____。
(3)气体A的成分是____,各成分的体积比是____。
(4)反应过程中消耗的锌的质量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92g铜粉与一定量的浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况下),则消耗硝酸的物质的量是
A.0.12molB.0.09molC.0.11molD.0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。
(1)铜元素在周期表中的位置是________________,Au位于第六周期,与Cu同族,写出Au基态原子的价电子排布式___________。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为____________。
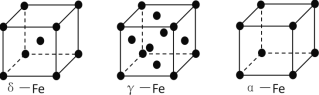
(3)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为_______________. 已知Fe原子半径为r pm,δ-Fe晶体的空间利用率为_________________。(只列式不化简)
(4)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中微粒之间的作用力是_________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为_______________。
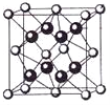
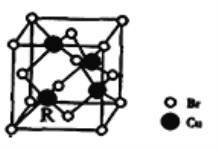
(5)一种铜的溴化物晶胞结构如下图所示其化学式是______________.已知该晶胞参数为anm,Cu的相对原子量为64,Br的相对原子量为80,阿伏加德罗常数为NA,求晶体密度ρ=_________g/cm3(只列式不化简).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素的最高正价依次为1、4、5、7,其核电荷数按B、C、D,A的次序增大;已知B原子的次外层电子数为2,C、D、A原子的次外层电子数均为8;A原子核外电子总数不超过![]() 。试回答:
。试回答:
(1)各元素符号为:A______B______C______D______
(2)写出B、C、D最高价氧化物对应水化物的分子式:______、______、______,并比较其酸性强弱:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
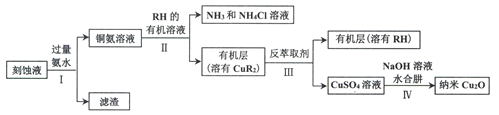
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
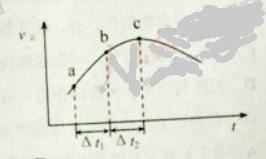
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com