
【题目】铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。
(1)铜元素在周期表中的位置是________________,Au位于第六周期,与Cu同族,写出Au基态原子的价电子排布式___________。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为____________。
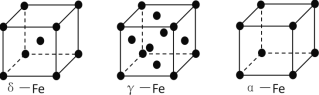
(3)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为_______________. 已知Fe原子半径为r pm,δ-Fe晶体的空间利用率为_________________。(只列式不化简)
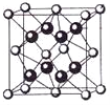
(4)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中微粒之间的作用力是_________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为_______________。
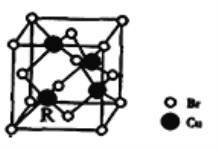
(5)一种铜的溴化物晶胞结构如下图所示其化学式是______________.已知该晶胞参数为anm,Cu的相对原子量为64,Br的相对原子量为80,阿伏加德罗常数为NA,求晶体密度ρ=_________g/cm3(只列式不化简).
【答案】第4周期ⅠB族 5d106s1 分子晶体 4:6:3  金属键 Cu3AuH8 CuBr
金属键 Cu3AuH8 CuBr 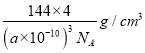
【解析】
(1)铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为5d106s1;
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。这此都是分子晶体具有的性质,;
(3)三种晶体中铁原子周围距离最近的铁原子个数之比为8:12:6=4:6:3;已知Fe原子半径为r pm,δ-Fe晶体的空间利用率=2个原子的体积与晶胞体积比,晶胞中铁原子的体积为:2×4/3×π×r3,体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:![]() ,晶胞体积为:
,晶胞体积为:![]() ,空间利用率为:
,空间利用率为: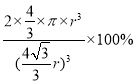
(4) 金属原子间形成金属键;氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
(5)该晶胞中Br原子个数=8×1/8+6×1/2=4,Cu原子个数为4,Br、Cu原子个数之比=4:4=1:1,其化学式为CuBr;若该溴化物晶胞参数为a pm,晶胞体积=(a×10-10cm)3,则该溴化物晶体的密度=m/V= =
=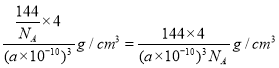
![]()


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】为了减少“84”消毒液对物品的腐蚀,天津一中高三师生给教室消毒使用的是二氧化氯泡腾片。二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体 ,其熔点为 -59℃,沸点为11.0℃,易溶于水。是目前国际上公认的新—代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面有广泛应用的高效安全消毒剂。与(Cl2)相比(ClO2)不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
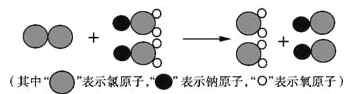
该反应的化学方程式为 ____________。
Ⅰ.ClO2是—种优良的消毒剂 ,浓度过高时易发生分解,为了运输和贮存便利常将其制成NaClO2固体 ,模拟工业上用过氧化氢法制备NaClO2固体的实验装置如图所示:
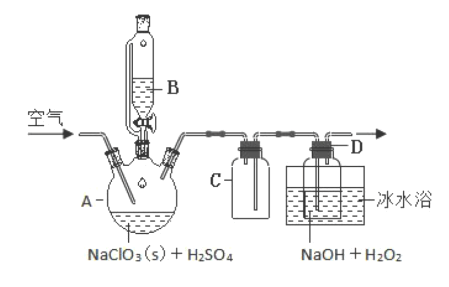
已知:H2O2沸点 150℃;A中的化学方程式:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(2)NaClO3放入仪器 A中,仪器B中的药品是________(写化学式)。
(3)如果仪器B 改成分液漏斗,实验过程中可能会出现的实验现象_______。
(4)向 A 装詈中通入空气,其作用是赶出ClO2然后通过C 再到 D 中反应。通空气不能过快的,空气流速过快时ClO2不能被充分吸收;通空气也不能过慢,其原因是_________。
(5)冰水浴冷却的目的是_____。
a.降低NaClO2的溶解度 b.减少H2O2的分解
c.使ClO2变为液态 d. 加快反应速率
Ⅱ.“稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。
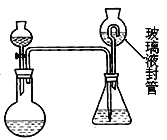
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
(6)为证实“稳定性二氧化氯溶液”中含有钠离子,方法是:______。
(7)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取 mg(2g 左右)试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液 ;②在锥形瓶中加入4g 碘化钾,用 100 mL水溶解后 ,再加 3 mL 硫酸溶液 ;③ 在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmo l/L硫代硫酸钠标准溶液滴定至蓝色消失 (![]() ), 共用去VmL 硫代硫酸钠溶液。
), 共用去VmL 硫代硫酸钠溶液。
①NaClO2与盐酸反应生成ClO2(还原产物为Cl-)该反应的化学方程式为:_______;
②ClO2通入锥形瓶与酸性碘化钾溶液反应,二氧化氯被还原为氯离子,该反应的离子方程式为:_______。
③“稳定性二氧化氯溶液”中,ClO2的质量分数为_____(用m、c、V表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ②
②![]() ③
③![]() ④C2H4 ⑤CH2=CH—CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH—CH=CH2 ⑥C3H6 ⑦![]() ⑧
⑧![]()
A.④和⑥B.①、②和③C.④、⑥和⑧D.⑤和⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,A、B、C、D、E为其中两种元素组成的常见化合物,基态Z原子核外有两个未成对电子,A、D均含有10个电子且中心原子的杂化方式相同,它们之间的转化关系如图所示(部分反应物或生成物省略),下列说法中不正确的是( )
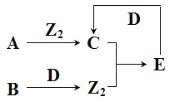
A.简单离子半径:Y>Z>W
B.若C中混有E可用水洗方法除去
C.每个D分子周围可以形成4个氢键
D.B与D反应生成Z2时,D作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年,中外科学家团队共同合成T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如图。下列说法错误的是( )

A.每个T-碳晶胞中含32个碳原子
B.T-碳中碳与碳的最小夹角为109.5。
C.T-碳属于原子晶体
D.如图是T-碳晶胞的俯视图

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,100mL0.1mol·L-1的H2A溶液中滴加0.1mol·L-1NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是( )
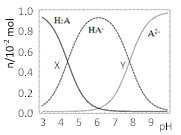
A.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
B.X点所加NaOH溶液体积为50mL
C.X点溶液中含A元素的相关离子存在以下关系:c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
D.Y点溶液中存在以下关系:c(H+)+c(Na+)=c(OH-)+3c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿佛加德罗常数,下列说法不正确的是( )
A.标准状况下,22.4 L氦气中含2NA个氦原子
B.18g水中含有的电子数为10NA
C.1mol Cl2与金属Na完全反应,可以得到2NA个电子
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z族序数之和为10;Y的原子半径在同周期主族元素中最小;W与Z形成的化合物常温下可与饱和NaCl溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是

A. X的单质是人类将太阳能转化为电能的常用材料
B. Y元素可以形成多种含氧酸
C. X元素在自然界中只有化合态没有游离态
D. W与Z形成的化合物与饱和NaCl溶液的反应要选用如上图装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com