
【题目】设NA为阿佛加德罗常数,下列说法不正确的是( )
A.标准状况下,22.4 L氦气中含2NA个氦原子
B.18g水中含有的电子数为10NA
C.1mol Cl2与金属Na完全反应,可以得到2NA个电子
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
【答案】A
【解析】
A.标准状况下,22.4 L氦气的物质的量为![]() =1mol,氦气为单原子分子,故含有氦原子数为NA,故A符合题意;
=1mol,氦气为单原子分子,故含有氦原子数为NA,故A符合题意;
B.18g水的物质的量为![]() =1mol,1个H2O分子中含有电子数为(8+2×1)=10个,因此1mol水中含有的电子数为10NA,故B不符合题意;
=1mol,1个H2O分子中含有电子数为(8+2×1)=10个,因此1mol水中含有的电子数为10NA,故B不符合题意;
C.Cl2与金属Na完全反应,氯元素化合价从0价降低为-1价,因此1mol Cl2完全反应得到电子2mol,其数目为2NA,故C不符合题意;
D.硝酸镁化学式为Mg(NO3)2,1L2mol/L的硝酸镁溶液中含有硝酸镁的物质的量为1L×2mol/L=2mol,硝酸根离子数为4NA,故D不符合题意;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。

(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。
(1)铜元素在周期表中的位置是________________,Au位于第六周期,与Cu同族,写出Au基态原子的价电子排布式___________。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为____________。
(3)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为_______________. 已知Fe原子半径为r pm,δ-Fe晶体的空间利用率为_________________。(只列式不化简)
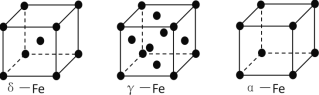
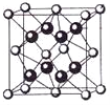
(4)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中微粒之间的作用力是_________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为_______________。
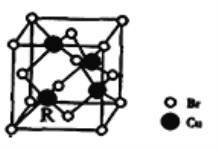
(5)一种铜的溴化物晶胞结构如下图所示其化学式是______________.已知该晶胞参数为anm,Cu的相对原子量为64,Br的相对原子量为80,阿伏加德罗常数为NA,求晶体密度ρ=_________g/cm3(只列式不化简).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PT(KHC2O4·H2C2O4·2H2O,名称:四草酸钾)是一种分析试剂。室温时,H2C2O4的pKa1、pKa2分别为1.23、4.19(pKa=-lgKa)。下列说法不正确的是( )
A.0.1mol·L-1PT溶液中:c(HC2O![]() )>c(K+)>c(H2C2O4)
)>c(K+)>c(H2C2O4)
B.0.1mol·L-1PT中滴加NaOH至溶液pH=4.19:c(C2O![]() )=c(HC2O
)=c(HC2O![]() )
)
C.0.1mol·L-1PT中滴加NaOH至溶液呈中性:c(K+)>c(Na+)>c(HC2O![]() )>c(C2O
)>c(C2O![]() )
)
D.0.1mol·L-1PT与0.1mol·L-1KOH溶液等体积混合,溶液中水的电离程度比纯水的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
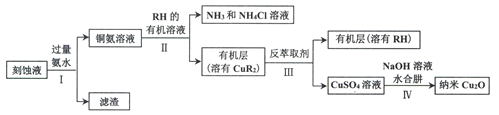
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是

A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4
B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4
C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液
D.溶度积:Ksp(SrSO4)<Ksp(PbSO4)<Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
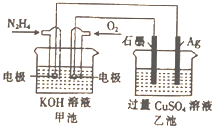
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 |
|
| HClO |
|
|
电离平衡常数 |
|
|
|
|
|
(1)25℃时,等浓度的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,3种溶液的pH由大到小的顺序为________。
溶液,3种溶液的pH由大到小的顺序为________。
(2)工业上可用氨水除去尾气![]() 。将
。将![]() 通入氨水中,当
通入氨水中,当![]() 降至
降至![]() _____。
_____。
(3)常温下,用![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图:
溶液所得滴定曲线如图:
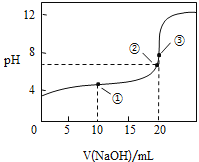
①在整个实验过程中,不需要的仪器或用品是 ______(填序号).
![]() 容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
②到达滴定终点的标志是 _____________ .
③下列操作会导致测定结果偏高的是 ______ .
A 碱式滴定管在装液前未用标准NaOH溶液润洗
B 滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C 碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D 达到滴定终点时,仰视读数
④如图点①所示溶液中![]() __________
__________![]() 填“>”“<”或“=”,下同,点②所示溶液中:
填“>”“<”或“=”,下同,点②所示溶液中:![]() ________
________![]() ,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com