
【题目】常温下,100mL0.1mol·L-1的H2A溶液中滴加0.1mol·L-1NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是( )
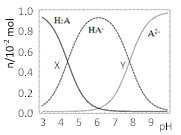
A.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
B.X点所加NaOH溶液体积为50mL
C.X点溶液中含A元素的相关离子存在以下关系:c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
D.Y点溶液中存在以下关系:c(H+)+c(Na+)=c(OH-)+3c(HA-)
【答案】D
【解析】
A.图中曲线分析可知溶液中存在酸H2A的分子,说明为弱酸,将等浓度等体积的Na2A与H2A溶液混合后恰好转化为NaHA,根据图像可知溶液显酸性,故A错误;
B.X点溶液中c(H2A)=c(HA-),X点所加NaOH溶液体积大于50mL,故B错误;
C.X点溶液中c(H2A)=c(HA-),X点溶液体积大于100mL,导致含有A微粒浓度之和减小,所以c(H2A)+c(HA-)+c(A2-)<0.1mol/L,故C错误,
D.根据图象分析,Y点溶液中c(HA-)=c(A2-),根据电荷守恒可知c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),则Y点溶液中存在以下关系:c(H+)+c(Na+)=c(OH-)+3c(HA-),故D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对杀伤肿瘤细胞有独特作用。下列有关汉黄芩素的叙述不正确的是( )
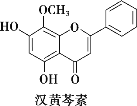
A.汉黄芩素的分子式为C16H12O5
B.该物质遇FeCl3溶液显紫色
C.与足量H2发生加成反应后,该分子中官能团的种类减少1种
D.1mol该物质与溴水反应,最多消耗2molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2。使一定量的锌与100mL18.5mol·L-1浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A33.6L。将反应后的溶液稀释到1L,测得溶液中氢离子的浓度为0.1mol·L-1。
(1)写出锌跟浓硫酸反应的化学方程式:____。
(2)反应过程中消耗的H2SO4的物质的量是____。
(3)气体A的成分是____,各成分的体积比是____。
(4)反应过程中消耗的锌的质量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。
(1)铜元素在周期表中的位置是________________,Au位于第六周期,与Cu同族,写出Au基态原子的价电子排布式___________。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为____________。
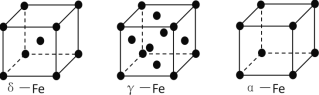
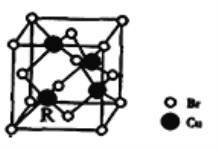
(3)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为_______________. 已知Fe原子半径为r pm,δ-Fe晶体的空间利用率为_________________。(只列式不化简)
(4)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中微粒之间的作用力是_________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为_______________。
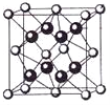
(5)一种铜的溴化物晶胞结构如下图所示其化学式是______________.已知该晶胞参数为anm,Cu的相对原子量为64,Br的相对原子量为80,阿伏加德罗常数为NA,求晶体密度ρ=_________g/cm3(只列式不化简).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素的最高正价依次为1、4、5、7,其核电荷数按B、C、D,A的次序增大;已知B原子的次外层电子数为2,C、D、A原子的次外层电子数均为8;A原子核外电子总数不超过![]() 。试回答:
。试回答:
(1)各元素符号为:A______B______C______D______
(2)写出B、C、D最高价氧化物对应水化物的分子式:______、______、______,并比较其酸性强弱:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PT(KHC2O4·H2C2O4·2H2O,名称:四草酸钾)是一种分析试剂。室温时,H2C2O4的pKa1、pKa2分别为1.23、4.19(pKa=-lgKa)。下列说法不正确的是( )
A.0.1mol·L-1PT溶液中:c(HC2O![]() )>c(K+)>c(H2C2O4)
)>c(K+)>c(H2C2O4)
B.0.1mol·L-1PT中滴加NaOH至溶液pH=4.19:c(C2O![]() )=c(HC2O
)=c(HC2O![]() )
)
C.0.1mol·L-1PT中滴加NaOH至溶液呈中性:c(K+)>c(Na+)>c(HC2O![]() )>c(C2O
)>c(C2O![]() )
)
D.0.1mol·L-1PT与0.1mol·L-1KOH溶液等体积混合,溶液中水的电离程度比纯水的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
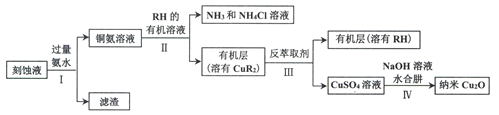
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭固定容器中,一定条件下发生Ni(s)+4CO(g) ![]() Ni(CO)4(g)的反应,该反应平衡常数(K)与温度(T)的关系如下表所示:
Ni(CO)4(g)的反应,该反应平衡常数(K)与温度(T)的关系如下表所示:
T/℃ | 25 | 80 | 230 |
K | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )。
A.上述生成Ni(CO)4(g)的反应为放热反应
B.230℃时,该反应的正反应为不自发的反应
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol·L-1
D.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com