
����Ŀ������Ԫ��W��X��Y��Z��ԭ�������������ӣ��Ҿ�������20��W��X��Z������֮��Ϊ10��Y��ԭ�Ӱ뾶��ͬ��������Ԫ������С��W��Z�γɵĻ����ﳣ���¿��뱥��NaCl��Һ��Ӧ�����������峣�����и�ͺ��ӽ���������˵���������

A. X�ĵ��������ཫ̫����ת��Ϊ���ܵij��ò���
B. YԪ�ؿ����γɶ��ֺ�����
C. XԪ������Ȼ����ֻ�л���̬û������̬
D. W��Z�γɵĻ������뱥��NaCl��Һ�ķ�ӦҪѡ������ͼװ��
���𰸡�D
��������
����Ԫ��W��X��Y��Z��ԭ�������������ӣ��Ҿ�������20��W��Z�γɵĻ����ﳣ���¿��뱥��NaCl��Һ��Ӧ�����������峣�����и�ͺ��ӽ�����������Ϊ��Ȳ����WΪCԪ�أ�ZΪCaԪ�أ�W��X��Z������֮��Ϊ10����X��������=10-4-2=4��λ�ڢ�A�壬��XΪSiԪ�أ�Y��ԭ�Ӱ뾶��ͬ��������Ԫ������С��Y��ԭ����������Si��λ�ڵ������ڣ�ΪClԪ�أ��ݴ˽��
���ݷ�����֪��WΪCԪ�أ�XΪSi��YΪCl��ZΪCaԪ�ء�
A.����SiΪ���õİ뵼����ϣ������ཫ̫����ת��Ϊ���ܵij��ò��ϣ�A��ȷ��
B.ClԪ�غ��ж��ֻ��ϼۣ������γɶ��ֺ����ᣬ������ᡢ���ᡢ������ȣ�B��ȷ��
C.SiΪ����Ԫ�أ�����Ȼ����ֻ�Ի���̬���ڣ�û������̬��C��ȷ��
D.̼���Ƽ�����ˮ��Ӧ������������ˮ�Ŀ�״���壬������ͼʾװ����ȡ��Ȳ��D����
�ʺ���ѡ����D��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ������������ģʹ�õĽ��������ǵĻ������ڿ�ѧ�о���ҵ�����о���������;��
��1��ͭԪ�������ڱ��е�λ����________________��Auλ�ڵ������ڣ���Cuͬ�壬д��Au��̬ԭ�ӵļ۵����Ų�ʽ___________��
��2����ï��[Fe(C5H5)2]����ɫ�����壬���������Ե���ζ�������ԡ��۵�172.5��173�棬100�������������е�249�����ݴ��ж϶�ï����������Ϊ____________��
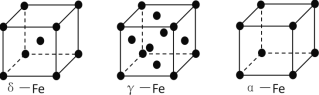
��3�������ġ��á�������ͬ�������壬��ͼ�����ǵľ���ṹͼ�����־�������ԭ����Χ�����������ԭ�Ӹ���֮��Ϊ_______________. ��֪Feԭ�Ӱ뾶Ϊr pm���ģ�Fe����Ŀռ�������Ϊ_________________����ֻ��ʽ��������
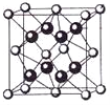
��4��ij�־��д���ܵ�ͭ�Ͻ�������������ܶѻ��Ľṹ��������Cuԭ�Ӵ������ģ�Auԭ�Ӵ��ڶ���λ�ã��þ�������֮�����������_________����ԭ�ӿɽ��뵽��Cuԭ����Auԭ�ӹ��ɵ��������϶�С�����Cuԭ����Auԭ�ӵ�ͬ�������þ��崢���ľ����ṹ�� CaF2�Ľṹ�������ṹ��ͼ�����ƣ��þ��崢���Ļ�ѧʽΪ_______________��
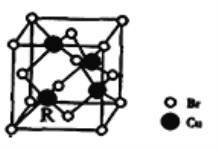
��5��һ��ͭ���廯�ᄃ���ṹ����ͼ��ʾ�仯ѧʽ��______________.��֪�þ�������Ϊanm��Cu�����ԭ����Ϊ64,Br�����ԭ����Ϊ80,�����ӵ�����ΪNA�������ܶ���=_________g/cm3��ֻ��ʽ������.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����A��B�����2L���ܱ������У��������з�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)����2min����D��Ũ��Ϊ0.5mol/L��c(A)��c(B)��3��5����C��ʾ��ƽ������v(C)��0.25mol��L1��min1������˵����ȷ����
xC(g)+2D(g)����2min����D��Ũ��Ϊ0.5mol/L��c(A)��c(B)��3��5����C��ʾ��ƽ������v(C)��0.25mol��L1��min1������˵����ȷ����
A. ��Ӧ����v(B)��0.25 mol��L��1��min��1
B. �÷�Ӧ����ʽ��x��1
C. 2minʱ��A�����ʵ���Ϊ1.5mol
D. 2minʱ��A��ת����Ϊ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���׳ص��ܷ�ӦʽΪ��N2H4+O2=N2+H2O�����й��ڸõ�ع���ʱ��˵����ȷ������ ��
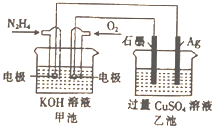
A. ��װ�ù���ʱ��Ag�缫������������
B. �׳��и�����ӦΪN2H4-4e-=N2+4H+
C. �׳غ��ҳ��е���Һ��pH����С
D. ���׳�������0.1molN2H4ʱ���ҳ���������������6.4g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��Ӧ![]() �ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ��
�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ��
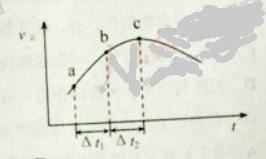
A. ��Ӧ��c ��ﵽƽ��״̬
B. ��Ӧ��Ũ�ȣ�![]() ��С��
����![]() ��
��
C. ��Ӧ��������������������������
D. ![]() ʱ��SO2��ת���ʣ�
ʱ��SO2��ת���ʣ�![]() ��С��
����![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����AԪ�ص�һ�ֵ�����һ����Ҫ�İ뵼����ϣ���AԪ�ص�һ�ֻ�����C��������������ܵ��ִ�ͨѶ���ϡ����ά��C���ռӦ���ɺ�AԪ�صĻ�����D��
��1����Ԫ�����ڱ��У�Aλ�ڵ�____�壬��Aͬ�嵫���ԭ��������AС��Ԫ��B��ԭ�ӽṹʾ��ͼΪ____________��A��B��ԭ�ӵĵ��Ӳ�ṹ�ϵ���ͬ����______��
��2������C������ѧ��Ӧ������__________����Ӧ�Ļ�ѧ����ʽ��_____________��
��3����C�봿���ϸ�������ʱ������ѧ��Ӧ����D��ͬʱ������B�����������E����������Eͨ��D��ˮ��Һ�У����ɺ�A�Ļ�����F��
�ٷֱ�д������D��F�Ļ�ѧ��Ӧ����ʽ��_______________��_________________��
��Ҫ����������ۻ������������в���ѡ�õ���_________
A.��ͨ��������![]() ʯӢ��������
ʯӢ��������![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����300mL���ܱչ̶������У�һ�������·���Ni(s)+4CO(g) ![]() Ni(CO)4(g)�ķ�Ӧ���÷�Ӧƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ���±���ʾ��
Ni(CO)4(g)�ķ�Ӧ���÷�Ӧƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ���±���ʾ��
T/�� | 25 | 80 | 230 |
K | 5��104 | 2 | 1.9��10��5 |
����˵������ȷ���ǣ� ����
A.��������Ni(CO)4(g)�ķ�ӦΪ���ȷ�Ӧ
B.230��ʱ���÷�Ӧ������ӦΪ���Է��ķ�Ӧ
C.80��ﵽƽ��ʱ�����n(CO)=0.3mol����Ni(CO)4��ƽ��Ũ��Ϊ2 mol��L��1
D.25��ʱ��ӦNi(CO)4(g) ![]() Ni(s)+4CO(g)��ƽ�ⳣ��Ϊ2��10-5
Ni(s)+4CO(g)��ƽ�ⳣ��Ϊ2��10-5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ |
|
| HClO |
|
|
����ƽ�ⳣ�� |
|
|
|
|
|
��1��25��ʱ����Ũ�ȵ�![]() ��Һ��
��Һ��![]() ��Һ��
��Һ��![]() ��Һ��3����Һ��pH�ɴ�С��˳��Ϊ________��
��Һ��3����Һ��pH�ɴ�С��˳��Ϊ________��
��2����ҵ�Ͽ��ð�ˮ��ȥβ��![]() ����
����![]() ͨ�백ˮ�У���
ͨ�백ˮ�У���![]() ����
����![]() _____��
_____��
��3�������£���![]() ��Һ�ζ�
��Һ�ζ�![]() ��Һ���õζ�������ͼ��
��Һ���õζ�������ͼ��
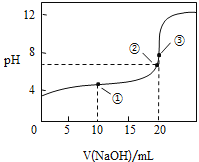
��������ʵ������У�����Ҫ����������Ʒ�� ______������ţ���
![]() ����ƿ b ��ƿc �ζ��ܼ�d ©��e ������f �ζ���
����ƿ b ��ƿc �ζ��ܼ�d ©��e ������f �ζ���
�ڵ���ζ��յ�ı�־�� _____________ ��
�����в����ᵼ�²ⶨ���ƫ�ߵ��� ______ ��
A ��ʽ�ζ�����װҺǰδ�ñ�NaOH��Һ��ϴ
B �ζ������У���ƿҡ����̫���ң���ƿ����Һ�ν���
C ��ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��յ�ʱ��������
D �ﵽ�ζ��յ�ʱ�����Ӷ���
����ͼ�����ʾ��Һ��![]() __________
__________![]() ������������������=������ͬ�������ʾ��Һ�У�
������������������=������ͬ�������ʾ��Һ�У�![]() ________
________![]() �������ʾ��Һ����������Ũ���ɴ�С��˳��Ϊ��_________��
�������ʾ��Һ����������Ũ���ɴ�С��˳��Ϊ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ִӷϾ�﮵���л���Li2SO4��CuSO4��CoSO4���м۽����Ĺ����������£�
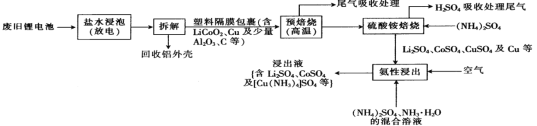
��֪������ˮ���ݡ��ǽ��Ͼ�﮵������ʳ��ˮ�н��ݷŵ磻�����Խ�����ʱ��Һ�������ԡ�
�ش��������⣺
(1)����ˮ���ݡ����зŵ磬�ŵ��Ŀ����________________________��
(2)��Ԥ���ա���Ŀ����____________________�����������ոù��̲�����β�����Լ���____________________��
(3)������隣��ա�ʱ������淋�������______________________________����H2SO4���մ���β���������Һ��ѭ�����ã�������隣��ա�ʱ��β���к�___________(�ѧʽ)��
(4)�����Խ�����ʱ��ͨ�������Ŀ����__________________________��
(5)�����Խ�����ʱ��Cu���ʱ�����Ϊ[Cu(NH3)4]SO4���÷�Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com