
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于第____族,与A同族但相对原子质量比A小的元素B的原子结构示意图为____________,A与B在原子的电子层结构上的相同点是______。
(2)易与C发生化学反应的酸是__________,反应的化学方程式是_____________。
(3)将C与纯碱混合高温熔融时发生化学反应生成D,同时还生成B的最高价氧化物E;将少量的E通入D的水溶液中,生成含A的化合物F。
①分别写出生成D和F的化学反应方程式:_______________,_________________。
②要将纯碱高温熔化,下列坩埚中不可选用的是_________
A.普通玻璃坩埚![]() 石英玻璃坩埚
石英玻璃坩埚![]() 铁坩埚
铁坩埚
【答案】ⅣA ![]() 最外层均有4个电子 氢氟酸
最外层均有4个电子 氢氟酸 ![]()
![]()
![]() AB
AB
【解析】
含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为![]() ,C与烧碱反应生成含A元素的化合物D为
,C与烧碱反应生成含A元素的化合物D为![]() ,
,
(1)A的最外层电子数为4,位于第ⅣA族,与A同族但相对原子质量比A小的元素B为C,其原子结构示意图为![]() ,二者最外层均有4个电子,
,二者最外层均有4个电子,
故答案为: ⅣA;![]() ;最外层均有4个电子;
;最外层均有4个电子;
(2)二氧化硅与氢氟酸反应生成四氟化硅与水,反应方程式为:![]() ,
,
故答案为:氢氟酸;![]() ;
;
(3)①.将![]() 与纯碱混合高温熔融时反应生成
与纯碱混合高温熔融时反应生成![]() ,同时还生成B的最高价氧化物E,则E为
,同时还生成B的最高价氧化物E,则E为![]() ,B为C,反应为
,B为C,反应为![]() ;将全部的
;将全部的![]() 与全部的
与全部的![]() 在足量的水中混合后,生成了含A的化合物F为
在足量的水中混合后,生成了含A的化合物F为![]() ,反应方程式为
,反应方程式为![]() ,
,
故答案为:![]() ;
;![]() ;
;
②.普通玻璃坩埚、石英玻璃坩埚中的二氧化硅在高温下都能与碳酸钠反应,应在铁坩埚中熔融,
故答案为:AB。


科目:高中化学 来源: 题型:
【题目】化合物I是β—氨基酮类化合物。利用Michael加成反应合成I的路线如图,回答下列问题:
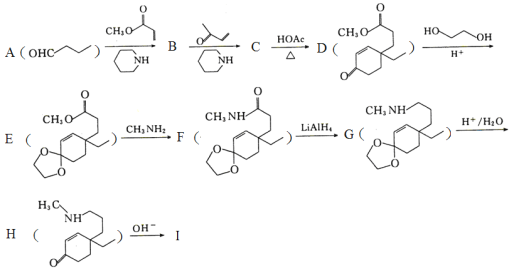
已知:①Michael加成反应通式为:A—CH2—R+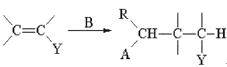 (A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、
(A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、![]() 等)
等)
②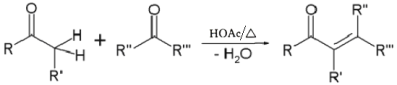
(1)A→B的化学方程式为___。
(2)化合物C和I的结构简式分别为___、___。
(3)B→C和E→F的反应类型分别是___、___。
(4)写出符合下列条件的D的同分异构体的结构简式___。
①与氢氧化钠完全反应时,二者物质的量之比为1:2;
②有4种不同化学环境的氢;
③能使FeCl3溶液显紫色。
(5)写出以苯甲醛、丙酸甲酯和![]() 为原料合成
为原料合成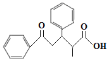 的合成路线___(其它试剂任选)
的合成路线___(其它试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,利用如图所示,可回收酸性废水中低浓度的铜,下列说法错误的是
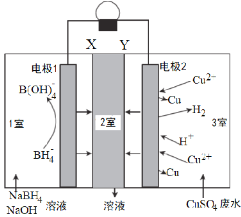
A.电极2为正极,只发生反应:Cu2++2e—=Cu
B.Y为阴离子交换膜,2室流出的溶液是Na2SO4溶液
C.每8molNaOH参加反应,有8mol电子转移
D.此装置在回收铜的同时还有电流产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z族序数之和为10;Y的原子半径在同周期主族元素中最小;W与Z形成的化合物常温下可与饱和NaCl溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是

A. X的单质是人类将太阳能转化为电能的常用材料
B. Y元素可以形成多种含氧酸
C. X元素在自然界中只有化合态没有游离态
D. W与Z形成的化合物与饱和NaCl溶液的反应要选用如上图装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.

![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现。某种兴奋剂的结构如下。关于它的说法正确的是( )
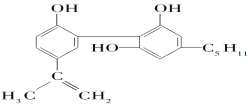
A.它的化学式为C19H26O3
B.该化合物只能发生取代反应
C.从结构上看,它属于醇类
D.从元素组成上看,它可以在氧气中燃烧生成CO2和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含多糖淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
![]()
![]()
![]() ―→
―→![]() ―→
―→![]() ―→
―→![]()
B是日常生活中常见的有特殊香味的有机物,在有些饮料中含有B。
(1)写出淀粉的分子式___,C中官能团的名称是__。
(2)B→C的反应类型是___(填字母)。
A.取代反应 B.加成反应 C.氧化反应 D.还原反应
(3)写出C完全燃烧的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com