
【题目】室温下,利用如图所示,可回收酸性废水中低浓度的铜,下列说法错误的是
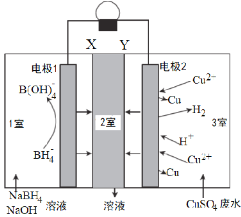
A.电极2为正极,只发生反应:Cu2++2e—=Cu
B.Y为阴离子交换膜,2室流出的溶液是Na2SO4溶液
C.每8molNaOH参加反应,有8mol电子转移
D.此装置在回收铜的同时还有电流产生
【答案】A
【解析】
由图可知,该装置为原电池。电极1处BH4-转化为B(OH)4-,发生氧化反应,故电极1为负极,电极方程式为:BH4-+8OH--8e-= B(OH)4-+4H2O。该反应导致1室中负电荷的减少,故1室中的阳离子会流入2室。电极2处Cu2+和H+转化为Cu和H2,发生还原反应,故电极2为正极,电极反应为:Cu2++2e-=Cu,2H++2e-= H2。该反应导致3室中阳离子减少,故3室中的阴离子流向2室。
A.根据分析,电极2为正极,电极反应为:Cu2++2e-=Cu,2H++2e-= H2,A错误;
B.根据分析,故1室中的阳离子(Na+)及3室中的阴离子(SO42-)会流入2室,故Y为阴离子交换膜,2室流出的溶液是Na2SO4溶液,B正确;
C.根据负极反应:BH4-+8OH--8e-=,B(OH)4-+4H2O,OH-与电子计量数之比为1:1,故每8molNaOH参加反应,有8mol电子转移,C正确;
D.该装置为原电池,有电流产生;正极反应中有Cu2++2e-=Cu,故可以回收Cu,D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】南京理工大学团队成功合成了能在温室稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经 X 射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是( )

A.所有N 原子的价电子层结构均有孤对电子
B.氮氮键的键能:N5->H2N-NH2
C.两种阳离子是等电子体
D.阴阳离子之间只存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是

A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4
B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4
C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液
D.溶度积:Ksp(SrSO4)<Ksp(PbSO4)<Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3)。

请回答下列问题:
(1)流程中“反应”的实验装置如图所示:

①反应时需控制在95℃进行,控制反应温度的适宜方法是____。
②反应产生的气体需要净化处理,请从图中选择合适的装置____(填字母代号)。

(2)根据如图所示,流程中“过滤”操作的适宜温度是________(填字母代号)。
A.0-20℃ B.20-40℃ C.50-60℃ D. 60-80℃

(3)根据H3BO3的电离反应:H3BO3+H2O![]() H++B(OH)4-,Ka=5.7×10-10,可判断H3BO3是____酸;将溶液pH调解至3.5目的是____。
H++B(OH)4-,Ka=5.7×10-10,可判断H3BO3是____酸;将溶液pH调解至3.5目的是____。
(4)实验时若被强碱溅到皮肤,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____。
(5)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是____。
(6)预测定硼酸的纯度,因硼酸酸性过弱不能直接滴定。可先将硼酸与甘油作用生成甘油硼酸(Ka=8.4×10-6),再用NaOH标准溶液滴定(酚酞作指示剂)。已知硼酸的摩尔质量为61.8g·mol-1,滴定前称取3.00g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.2000mol·L-1NaOH标准液的平均体积为20.00mL。
①计算所得硼酸的纯度____
②若用NaOH标准溶液直接滴定硼酸,测得的硼酸的纯度将____(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
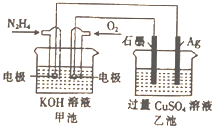
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是:

A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图3表示H2与O2发生反应过程中的能量变化,则氢气的燃烧热为241.8kJ·mo1ˉ1
D. 图4表示用水稀释等体积且pH相同的盐酸和醋酸,溶液导电性:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于第____族,与A同族但相对原子质量比A小的元素B的原子结构示意图为____________,A与B在原子的电子层结构上的相同点是______。
(2)易与C发生化学反应的酸是__________,反应的化学方程式是_____________。
(3)将C与纯碱混合高温熔融时发生化学反应生成D,同时还生成B的最高价氧化物E;将少量的E通入D的水溶液中,生成含A的化合物F。
①分别写出生成D和F的化学反应方程式:_______________,_________________。
②要将纯碱高温熔化,下列坩埚中不可选用的是_________
A.普通玻璃坩埚![]() 石英玻璃坩埚
石英玻璃坩埚![]() 铁坩埚
铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理控制、利用燃煤排放的CO2、SO2、CO是优化环境的有效途径。
(1)CO2生产甲醇方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
已知:2H2(g)+O2(g)===2H2O(g) ΔH=b kJ·mol1;
H2O(g)===H2O(l) ΔH=c kJ·mol1;
CH3OH(g)===CH3OH(l) ΔH=d kJ·mol1。
则表示CH3OH(l)燃烧热的热化学方程式为_________________________________。
(2)工业生产中用SO2为原料制取硫酸


①利用原电池将SO2 转化法,如图(a)所示,则负极的电极反应式为____________。
②电解Na2SO3溶液吸收SO2得到的NaHSO3法,如图(b)所示,则阳极反应式______。
(3)光气 (COCl2)是一种重要的化工原料,工业上通过Cl2(g)+CO(g) ![]() COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:
COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:

①该反应的正反应是___________ 反应(填“放热”或“吸热”)。
②0~6 min内,反应的平均速率v(Cl2)=_______;该温度下的平衡常数为______。
③若恒温恒容时,在第7 min 向体系中加入这三种物质各2 mol,则平衡_____移动(填“向左”、“向右”或“不”)。
④若恒温恒压时,初始投料浓度为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol·L1、c(COCl2)=______mol·L1,最终达到化学平衡时,Cl2的体积分数与上述第6 min时的相同。
⑤第n min反应温度表示为T(n ),则:T(8)_____T(15) (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图装置为某新型燃料电池的工作示意图,以HCl-NH4Cl溶液为电解质溶液。下列有关说法中正确的是( )

A. 通入H2的电极为正极
B. 该电池的负极反应式为:N2+6e-+8H+===2NH![]()
C. 图中分离出的A物质为NH4Cl
D. 该电池工作一段时间后,溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com