
【题目】以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3)。

请回答下列问题:
(1)流程中“反应”的实验装置如图所示:

①反应时需控制在95℃进行,控制反应温度的适宜方法是____。
②反应产生的气体需要净化处理,请从图中选择合适的装置____(填字母代号)。

(2)根据如图所示,流程中“过滤”操作的适宜温度是________(填字母代号)。
A.0-20℃ B.20-40℃ C.50-60℃ D. 60-80℃

(3)根据H3BO3的电离反应:H3BO3+H2O![]() H++B(OH)4-,Ka=5.7×10-10,可判断H3BO3是____酸;将溶液pH调解至3.5目的是____。
H++B(OH)4-,Ka=5.7×10-10,可判断H3BO3是____酸;将溶液pH调解至3.5目的是____。
(4)实验时若被强碱溅到皮肤,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____。
(5)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是____。
(6)预测定硼酸的纯度,因硼酸酸性过弱不能直接滴定。可先将硼酸与甘油作用生成甘油硼酸(Ka=8.4×10-6),再用NaOH标准溶液滴定(酚酞作指示剂)。已知硼酸的摩尔质量为61.8g·mol-1,滴定前称取3.00g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.2000mol·L-1NaOH标准液的平均体积为20.00mL。
①计算所得硼酸的纯度____
②若用NaOH标准溶液直接滴定硼酸,测得的硼酸的纯度将____(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
【答案】水浴加热 B C 一元弱酸 转化为H3BO3,促进析出 H3BO3+OH-=B(OH)4- 多次使用后母液中杂质的浓度增大,再次重结晶时,会析出杂质,影响产品的纯度 82.4% B
【解析】
硼镁矿(含 Mg2B2O5H2O、SiO2 及少量 Fe2O3、Al2O3)加入(NH4)2SO4溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,过滤中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=3.5时得到H3BO3;
(1)①水浴加热可以受热均匀,更好的控制温度;
②据流程图知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,氨气极易溶于水,属于碱性气体,所以选择既要防制倒吸,又能和氨气反应的物质进行除杂处理;
(2)根据图2可知温度为50-60℃之间时两者的溶解度差值最大;
(3)根据H3BO3的电离反应:H3BO3+H2OH++B(OH)4-,Ka=5.7×10-10,只能电离出一个H+;将溶液pH调解至3.5有利于强酸制弱酸;
(4)硼酸属于一元弱酸,能和强碱反应生成盐和水;
(5)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理;
(6)①由于H3BO3是一元 酸,所以消耗NaOH的物质的量与H3BO3的物质的量为1:1,则![]() ,所以根据m=nM可求出样品中硼酸的质量,最终可求出纯度;
,所以根据m=nM可求出样品中硼酸的质量,最终可求出纯度;
②若用NaOH标准溶波直接滴定硼酸,生成的硼酸钠水解显碱性,由于硼酸是很弱的酸,越弱越水解,会导致加入的NaOH量偏少就达到滴定终点,所以会导致硼酸的纯度偏小。
(1)①控制温度在100℃以下,一般用水浴加热;
②加入(NH4)2SO4后生成的气体为NH3,NH3极易溶于水,吸收时需要注意防倒吸。
A.多孔泡球浸入硫酸中,不能防倒吸,A错误;
B.球形干燥管插入硫酸中,有防倒吸的功能,B正确;
C.碱石灰不能吸收NH3,C错误;
D.饱和食盐水可以溶解NH3,不能防倒吸,D错误;
故选B;
(2)过滤后要得到硼酸,需要让硼酸基本不溶,而MgSO4几乎全溶,图中50-60℃时MgSO4的溶解度最大,而硼酸的溶解度较小,符合题意,故选C;
(3)由H3BO3的电离反应:H3BO3+H2O![]() H++B(OH)4-可知H3BO3是一元酸,由Ka=5.7×10-10可知H3BO3是弱酸;由于H3BO3是弱酸,调pH至3.5目的是让溶液中的硼酸盐转化为H3BO3,促进析出;
H++B(OH)4-可知H3BO3是一元酸,由Ka=5.7×10-10可知H3BO3是弱酸;由于H3BO3是弱酸,调pH至3.5目的是让溶液中的硼酸盐转化为H3BO3,促进析出;
(4)硼酸是弱酸,可以与碱反应,根据已知H3BO3的电离反应,可以看出硼酸与碱反应的离子方程式是:H3BO3+OH-=B(OH)4-;
(5)每次结晶后,杂质都会留在母液中,多次使用后母液中杂质的浓度增大,再次重结晶时,会析出杂质,影响产品的纯度;
(6)①滴定至终时,消耗0.2000mol·L-1NaOH标准液的平均体积为20.00mL,这些NaOH的物质的量为![]() ,由于H3BO3是一元 酸,所以消耗NaOH的物质的量与H3BO3的物质的量为1:1,则
,由于H3BO3是一元 酸,所以消耗NaOH的物质的量与H3BO3的物质的量为1:1,则![]() 。所以样品中硼酸的质量为
。所以样品中硼酸的质量为![]() ,纯度为
,纯度为![]() ;
;
②若用NaOH标准溶波直接滴定硼酸,生成的硼酸钠水解显碱性,由于硼酸是很弱的酸,越弱越水解,会导致加入的NaOH量偏少就达到滴定终点,所以会导致硼酸的纯度偏小,故选B;


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH![]() 的数目为NA
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H为八种短周期主族元素,原子序数依次增大。A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、H在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17。D与F同周期。G的单质常用作半导体材料。请回答:
(1)C和H分别与A形成的简单化合物沸点较高的是________(填化学式),理由是_____________。
(2)C、E形成的简单离子半径大小:r(C)______r(E)(填>、<或=)
(3)请写出F最高价氧化物对应的水化物在水溶液中的电离方程式______________。
(4)B与G形成的化合物常用于做耐高温材料,工业可用碳热还原法制取:将G的氧化物与B的单质在1400℃条件下和足量的碳反应,请写出化学反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是_______
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
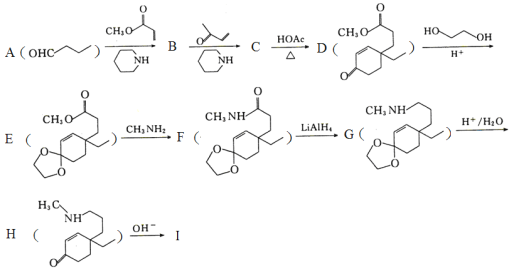
【题目】化合物I是β—氨基酮类化合物。利用Michael加成反应合成I的路线如图,回答下列问题:
已知:①Michael加成反应通式为:A—CH2—R+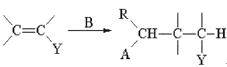 (A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、
(A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、![]() 等)
等)
②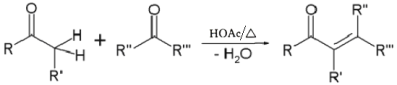
(1)A→B的化学方程式为___。
(2)化合物C和I的结构简式分别为___、___。
(3)B→C和E→F的反应类型分别是___、___。
(4)写出符合下列条件的D的同分异构体的结构简式___。
①与氢氧化钠完全反应时,二者物质的量之比为1:2;
②有4种不同化学环境的氢;
③能使FeCl3溶液显紫色。
(5)写出以苯甲醛、丙酸甲酯和![]() 为原料合成
为原料合成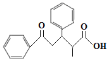 的合成路线___(其它试剂任选)
的合成路线___(其它试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.1molAl分别与足量的稀硫酸和稀硝酸反应转移电子数均为3NA
B.0.1molN4S4(结构如图所示)含有NA个S—N键
C.标准状况下,1mol甲基(—14CD3)所含的中子数为10NA
D.1molCH3COOC2H5在稀硫酸中水解可得到的乙醇分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,利用如图所示,可回收酸性废水中低浓度的铜,下列说法错误的是
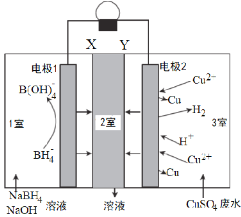
A.电极2为正极,只发生反应:Cu2++2e—=Cu
B.Y为阴离子交换膜,2室流出的溶液是Na2SO4溶液
C.每8molNaOH参加反应,有8mol电子转移
D.此装置在回收铜的同时还有电流产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中 E1 表示无催化剂时正反应的活化能,E2 表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中 E1 表示无催化剂时正反应的活化能,E2 表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
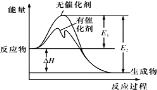
A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B.该反应中,反应物的总键能大于生成物的总键能
C.500℃、101kPa 下,将 1molSO2(g)和 0.5molO2(g)置于密闭容器中充分反应生成 SO3(g)放热 akJ,其热化学方程式为 2SO2(g) + O2(g)![]() 2SO3(g) ΔH<-2a kJ·mol-l
2SO3(g) ΔH<-2a kJ·mol-l
D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com