
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )
A.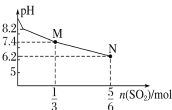 表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
B.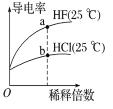 a点Kw的数值比b点Kw的数值大
a点Kw的数值比b点Kw的数值大
C.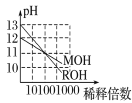 表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D.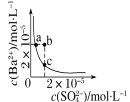 表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
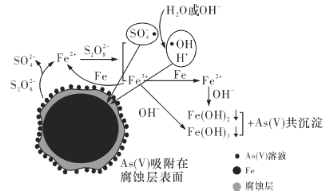
A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56 g Fe参加反应,被还原的S2O82-大于NA个
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中(假设pH接近7)c(Fe3+)为2.7×10-32 mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种线性高分子,结构如下图所示。
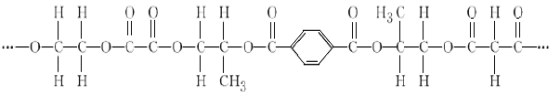
完成下列填空:
(1)该高分子由______种单体(聚合成高分子的简单小分子)聚合而成。
(2)写出上述单体中相对分子质量最小和相对分子质量最大的分子间发生缩聚反应的化学方程式__________________________________________________。
(3)上述单体中相对分子质量最小的分子在一定条件下完全消去后所得物质的结构简式为 。该物质加聚生成的高分子(填“能”或“不能”)________与溴的CCl4溶液发生加成反应。该物质三分子聚合成环,所得物质的名称是_______。
(4)上述单体中其中互为同系物的是(写出所有可能,用结构简式表述) 。
(5)与上述单体中相对分子质量最大的物质互为同系物,且相对分子质量多14的结构有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①![]()
②![]()
③![]()
则![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式为________________________________。
的热化学方程式为________________________________。
(2)反应:![]() 。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入
。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入![]() 、
、![]() 各0.5mol,气体混合物中碘化氢的物质的量
各0.5mol,气体混合物中碘化氢的物质的量![]() 与反应时间
与反应时间![]() 的关系如下表:
的关系如下表:
| 0 | 20 | 40 | 60 | 80 | 120 |
A容器 | 1 | 0.91 | 0.85 | 0.81 | 0.795 | 0.784 |
B容器 | 0 | 0.6 | 0.73 | 0.77 | 0.78 | 0.784 |
①120min时,可判断A、B容器反应处于平衡状态,理由是________________。716K时,该反应的平衡常数K=_________________(只列计算式即可)。
②上述反应中,正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,其中
,其中![]() 、
、![]() 为速率常数,则
为速率常数,则![]() ________________(以K和
________________(以K和![]() 逆表示)。
逆表示)。
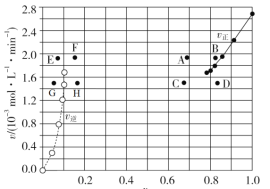
③由A容器中实验数据计算得到![]() 和
和![]() 的关系可用如图表示(
的关系可用如图表示(![]() 为物质的量分数)。当降低到某一温度时,反应重新达到平衡,
为物质的量分数)。当降低到某一温度时,反应重新达到平衡,![]() 和
和![]() 相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。
相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(![]() )。回答下列问题:
)。回答下列问题:
(1)Co在元素周期表中的位置为_________,Co2+价层电子排布式为______________。
(2)Co、Ni可形成![]() 、
、![]() 、
、![]() 等多种配合物。
等多种配合物。
①![]() 的空间构型为__________,
的空间构型为__________,![]() 中N原子的杂化轨道类型为_________。
中N原子的杂化轨道类型为_________。
②C、N、O、S四种元素中,第一电离能最大的是_____________。
③![]() 中含有σ键的数目为__________;已知NF3比NH3的沸点小得多,试解释原因________________________________________。
中含有σ键的数目为__________;已知NF3比NH3的沸点小得多,试解释原因________________________________________。
(3)常用丁二酮肟来检验Ni2+,反应如下:
Ni2+(aq)+2 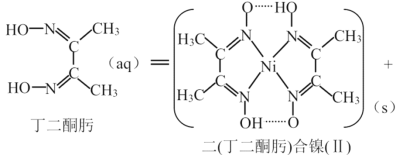 2H+(aq)
2H+(aq)
①1个二(丁二酮肟)合镍(Ⅱ)中含有_________________个配位键。
②上述反应的适宜![]() 为_________________(填字母序号)
为_________________(填字母序号)
A.12 B.5~10 C.1
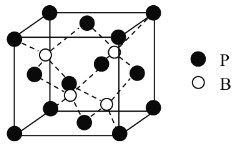
(4)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为![]() ,计算晶体中硼原子和磷原子的最近核间距为___________
,计算晶体中硼原子和磷原子的最近核间距为___________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
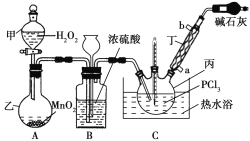
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验淀粉水解的情况,进行如下图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6 min,试管乙不加热。待试管甲中的溶液冷却后再进行后续实验。

实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式: 。
(2)设计甲和乙是为了探究 对淀粉水解的影响,设计甲和丙是为了探究 对淀粉水解的影响。
(3)实验1失败的原因是 。
(4)实验3中溶液的颜色无明显变化的原因是 。
(5)下列结论合理的是 (填字母)。
a.淀粉水解需要在催化剂和一定温度下进行
b.欲检验淀粉是否完全水解,最好在冷却后的水解液中直接加碘
c.欲检验淀粉的水解产物具有还原性,应先在水解液中加入氢氧化钠中和稀硫酸至溶液呈碱性,再加入新制氢氧化铜并加热
d.若用唾液代替稀硫酸,则实验1可能出现预期的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
A. 蚕丝属于天然高分子材料
B. 蚕丝的主要成分是蛋白质
C. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
D. “蜡炬成灰”过程中发生了氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com