
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.27g Al3+所含离子数为3NA
B.11.2L氢气完全燃烧转移的电子数目为NA
C.常温常压下32g氧气所含的原子数目为2NA
D.标准状况下,22.4 L水中含有的水分子数为NA
科目:高中化学 来源: 题型:
【题目】(多选)某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( ) 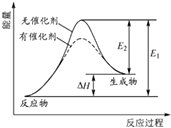
A.该反应为吸热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.4mol OH﹣的质量为 , 其中含有个电子.
(2)质量比为16:7:6的三种气体S02、CO、NO,氧原子个数之比为;同条件下体积比为 .
(3)标准状况下,1体积水能溶解448体积HCl,所得溶液的密度为1.1g/mL,该溶液的质量分数和物质的量的浓度分别是、 . (保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)CH3OH(g)△H=a kJmol﹣1 . 向体积为2L的密闭容器中充入2mol CO和4mol H2 , 测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示: 
(1)能判断反应达到化学平衡状态的是(填字母).
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 .
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1T3(填“>”“<”“=”),此正反应是反应(填“放热或吸热”).
(3)①反应Ⅰ在6min时达到平衡,从反应开始到达到平衡时v (CH3OH)=mol/(Lmin).
②反应Ⅱ在2min时达到平衡,计算该温度下的平衡常数K= . 在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和3mol CH3OH后,平衡将向(填“正反应、逆反应和不移动”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按能量由低到高的顺序排列,正确的一组是( )
A.1s、2p、3d、4s
B.1s、2s、3s、2p
C.2s、2p、3s、3p
D.4p、3d、4s、3p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K、L、M三个电子层.回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子,有种不同能级的电子,基态的F3+核外电子排布式是 .
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 .
(3)化合物AC2的电子式是 .
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 .
(5)化合物EF[F(AB)6]是一种蓝色晶体,如图1表示其晶胞的 ![]() (E+未画出).该蓝色晶体的一个晶胞中E+的个数为 .
(E+未画出).该蓝色晶体的一个晶胞中E+的个数为 . 
(6)G的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2):该配离子中含有的化学键类型有 . (填字母) 
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB﹣中的A原子与乙二胺(H2N﹣CH2一CH2一NH2)中C原子的杂化方式分别为和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池在酸性介质中的正极反应式:O2+4H++4e﹣═2H2O
B.用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e﹣=Cu2+
D.反应HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0,在理论上能用于设计原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n > m ,则下列关系正确的是
A. a > b > cB. a > c > bC. a = c + m - nD. a = c – n - m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以乙苯催化脱氢制取苯乙烯的反应如下: ![]() (g)
(g) ![]()
![]() (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定.在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示.
已知:气体分压(p分)=气体总压(p总)×体积分数.
不考虑副反应,下列说法正确的是( )
A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低
B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= ![]() ×p总
×p总
D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com