
【题目】已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K、L、M三个电子层.回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子,有种不同能级的电子,基态的F3+核外电子排布式是 .
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 .
(3)化合物AC2的电子式是 .
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 .
(5)化合物EF[F(AB)6]是一种蓝色晶体,如图1表示其晶胞的 ![]() (E+未画出).该蓝色晶体的一个晶胞中E+的个数为 .
(E+未画出).该蓝色晶体的一个晶胞中E+的个数为 . 
(6)G的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2):该配离子中含有的化学键类型有 . (填字母) 
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB﹣中的A原子与乙二胺(H2N﹣CH2一CH2一NH2)中C原子的杂化方式分别为和
【答案】
(1)K;17;5;1s22s22p63s23p63d5
(2)NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键
(3)![]()
(4)K2Fe(SCN)5
(5)4
(6)abd;sp;sp3
【解析】解:A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,A、B、C、D、E为不同主族的元素,A、C的最外层电子数都是其电子层数的2倍,A为C、C为S元素;透过蓝色钴玻璃观察E的焰色反应为紫色,则E为K元素,D原子序数大于C而小于E为主族元素,则D是Cl元素;
B的电负性大于C,且原子序数小于C,且主族元素处于不同主族,则B为N元素;
F的基态原子中有4个未成对电子,且位于第四周期元素,则F为Fe元素;G的+1价阳离子正好充满K、L、M三个电子层,则G为Cu元素;(1)元素的金属性越强,其第一电离能越小,这几种元素中金属性最强的是K,则第一电离能最小的是K;
D是Cl元素,原子核外有多少个电子,电子就有多少种运动状态,所以Cl元素原子核外电子有17种运动状态,有5种不同的能级;F是Fe元素,失去三个电子生成铁离子,铁离子核外有23个电子,根据构造原理知铁离子核外电子排布式为1s22s22p63s23p63d5 ,
所以答案是:K;17;5;1s22s22p63s23p63d5;(2)B的氢化物是氨气、C的氢化物是硫化氢、A的氢化物是甲烷,硫化氢、甲烷和水分子不能形成氢键、氨气和水分子能形成氢键,氢键的存在促进其溶解度增大,所以氨气的溶解度大于甲烷和硫化氢,
所以答案是:NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键;(3)化合物CS2的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)FeCl3与KSCN溶液混合得到含多种配合物的血红色溶液,生成的配合物为铁氰化钾,其中配位数为5的配合物的化学式是K2Fe(SCN)5 , 所以答案是:K2Fe(SCN)5;(5)化合物KFe[Fe(CN)6]是一种蓝色晶体,如图1表示其晶胞的
;(4)FeCl3与KSCN溶液混合得到含多种配合物的血红色溶液,生成的配合物为铁氰化钾,其中配位数为5的配合物的化学式是K2Fe(SCN)5 , 所以答案是:K2Fe(SCN)5;(5)化合物KFe[Fe(CN)6]是一种蓝色晶体,如图1表示其晶胞的 ![]() (E+未画出),该晶胞中Fe2+个数=
(E+未画出),该晶胞中Fe2+个数= ![]() =4,Fe3+个数=
=4,Fe3+个数= ![]() =4,CN﹣个数=12×
=4,CN﹣个数=12× ![]() ×8=24,根据化合物中各元素化合价的代数和为0知,K+个数=
×8=24,根据化合物中各元素化合价的代数和为0知,K+个数= ![]() =4,所以答案是:4;(6)Cu的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2),C﹣C原子之间存在非极性键、C﹣N和C﹣H及N﹣H原子之间存在极性键,铜离子和氮原子之间存在配位键,所以该配离子中含有的化学键类型有配位键、极性键、非极性键,故选abd;
=4,所以答案是:4;(6)Cu的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2),C﹣C原子之间存在非极性键、C﹣N和C﹣H及N﹣H原子之间存在极性键,铜离子和氮原子之间存在配位键,所以该配离子中含有的化学键类型有配位键、极性键、非极性键,故选abd;
SCN﹣中的C原价层电子对个数是2且不含孤电子对,所以C原子杂化方式为sp,乙二胺(H2N﹣CH2一CH2一NH2)中C原子价层电子对个数是4且不含孤电子对,所以C的杂化方式为sp3 ,
所以答案是:abd;sp;sp3 .


科目:高中化学 来源: 题型:
【题目】据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
已知:①CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.8kJ/mol
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
(1)写出由CO2和H2反应合成CH3CH2OH(l)和H2O(l)的热化学方程式
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景.该燃料电池中,使用铂作电极,KOH溶液做电解质溶液.通入乙醇燃气的一极为极,该极上的电极反应式为 .
(3)用乙醇燃料电池电解400mL 饱和食盐水装置可简单表示如图:该装置中发生电解反应的方程式为;在铁棒附近观察到的现象是;当阴极产生448mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 . (不考虑气体的溶解及溶液体积的变化) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容的密闭窗口中充入0.1mol/LCO2 , 0.1mol/L CH4 , 在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( ) 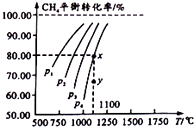
A.上述反应的△H<0
B.压强:P4>P3>P2>P1
C.1100℃时该反应平衡常数为1.64
D.压强为P4时,在y点:V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如图探究实验:
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,若盐桥中装有饱和的KNO3溶液和琼胶制成的胶冻,则NO3﹣移向装置(填写“甲或乙”).其他条件不变,若将CuCl2溶液换为NH4Cl溶液,发现生成无色无味的单质气体,则石墨上电极反应式 . 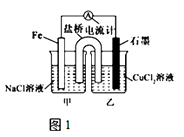
(2)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲装置是(填“原电池或电解池”),乙装置中石墨(2)为极,乙装置中与铁线相连的石墨(1)电极上发生的反应式为 . 
(3)在图2乙装置中改为加入CuSO4溶液,一段时间后,若某一电极质量增重 1.28g,则另一电极生成mL(标况下)气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.27g Al3+所含离子数为3NA
B.11.2L氢气完全燃烧转移的电子数目为NA
C.常温常压下32g氧气所含的原子数目为2NA
D.标准状况下,22.4 L水中含有的水分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. 酸性:H2SO3>H2CO3B. 还原性:S2->Cl-
C. 气态氢化物的稳定性:NH3 > CH4D. Cl2从KI溶液中置换出I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:甲 ![]() 乙
乙 ![]() 丙,下列说法不正确的( )
丙,下列说法不正确的( )
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3 , 则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①写出该反应的平衡常数K的表达式
②由表中数据判断该反应的△H0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 , 在0~5min内,以H2表示的平均反应速率为molL﹣1min﹣1 , 平衡时CH3OH的浓度为molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com