
����Ŀ������Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո�
��1�������ڷŵ�ʱ��ԭ������ã��ڳ��ʱ����ص����ã�Ǧ�����ڷŵ�ʱ�����ĵ�ط�ӦʽΪ�� ��
��2��FeCl3��Һ�����ڸ�ʴӡˢ��·ͭ�壬����2FeCl3+Cu�T2FeCl2+CuCl2 �� �����˷�Ӧ��Ƴ�ԭ��أ������õ缫����Ϊ �� ����·��ת��0.2mol����ʱ����ʴͭ������Ϊg
��3������Ƭ��ͭƬ�õ���������һ�����Ũ�����У�һ������ռ���Һ�У��ֱ��γ���ԭ��أ���������ԭ����У������ֱ�Ϊ ��
A.��Ƭ��ͭƬ
B.ͭƬ����Ƭ
C.��Ƭ����Ƭ
��4��ȼ�ϵ����һ�ָ�Ч�������ѺõĹ���װ�ã���ͼ�Ǽ���ȼ�ϵ��ԭ��ʾ��ͼ�� 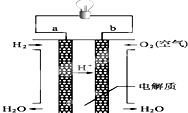
�ش��������⣺
������ȼ�ϵ�ص��ܷ�Ӧ��ѧʽ�ǣ� ��
�ڵ�ع���һ��ʱ���������Һ��pH�����������С�����䡱����
���𰸡�
��1��Pb+PbO2+2H2SO4=2PbSO4+2H2O
��2��Cu��6.4
��3��B
��4��2H2+O2=2H2O������
���������⣺��1���ŵ�ʱ��������PbO2�õ��ӣ�������ӦʽΪPbO2+4H++SO42��+2e���TPbSO4+2H2O��������Pbʧ���ӣ�Pb+SO42����2e���TPbSO4 �� �ܷ�ӦΪ��Pb+PbO2+2H2SO4=2PbSO4+2H2O�� ���Դ��ǣ�Pb+PbO2+2H2SO4=2PbSO4+2H2O����2���õ�ط�Ӧ�У�ͭʧ���ӷ���������Ӧ����������������ӦʽΪCu��2e��=Cu2+ �� ����·��ת��0.2mol����ʱ����Ӧ��CuΪ0.1mol��������Ϊ6.4g��
���Դ��ǣ�Cu��6.4����3����Ƭ��ͭƬ����ŨHNO3��Һ�У���������ۻ�������ͭ��Ũ����֮��ᷢ���Է���������ԭ��Ӧ����ʱ����ͭʱ��������������������
����ϡNaOH��Һ�У�����ͭ��������Ӧ���������ܺ��������Ʒ����Է���������ԭ��Ӧ����ʱ�������Ǹ���������ͭ��������
���Դ��ǣ�B����4��������ȼ�ϵ�ص��ܷ�Ӧ����������������Ӧ����ˮ���䷴Ӧ���ܷ���ʽΪ��2H2+O2=2H2O��
���Դ��ǣ�2H2+O2=2H2O������֪����ȼ�ϵ�ص��ܷ�ӦΪ��2H2+O2=2H2O����ع���һ��ʱ�������ˮʹ��Һ��������������Ũ�ȼ�С��pH����
���Դ��ǣ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������â�3FeCl2+4H2O ![]() Fe3O4+6HCl+H2��Fe3O4+
Fe3O4+6HCl+H2��Fe3O4+ ![]() Cl2+6HCl
Cl2+6HCl ![]() 3FeCl3+3H2O+
3FeCl3+3H2O+ ![]() O2 ��3FeCl3
O2 ��3FeCl3 ![]() 3FeCl2+
3FeCl2+ ![]() Cl2 ��������Ӧ��������ѭ������Ҫ���������ܽ����������Դ�����ij�����壬�������ǣ� ��
Cl2 ��������Ӧ��������ѭ������Ҫ���������ܽ����������Դ�����ij�����壬�������ǣ� ��
A.O2
B.Cl2
C.HCl
D.H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱյ�2L������װ��4mol SO2��2mol O2 �� ��һ�������¿�ʼ��Ӧ2SO2��g��+O2��g��2SO3��g����2minĩ�����������1.6mol SO2 �� ����㣺
��1��2minĩSO3��Ũ�ȣ�
��2��2min��SO2��ƽ����Ӧ���ʣ�
��3��2minĩSO2��ת���ʣ�
��4����Ӧǰ���ѹǿ֮�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Fe��Fe2O3�Ļ�������300mL 2mol/L��������Һ�У���Ӧ��ȫ������ʣ�࣬����4.48L NO���壨��״����������Ӧ�����Һ�м���1mol/L��NaOH��Һ��Ҫʹ��Ԫ��ȫ����������������NaOH��Һ����������ǣ� ��
A.400mL
B.500mL
C.450mL
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A3+��������46�����ӣ�������Ϊ115����Aԭ�Ӻ�����������ǣ� ��
A. 46B. 66C. 115D. 49
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У������ˣ������������ܽ⣻��ȡҺ���Լ�����ȡ�����Լ���һ��Ҫ�õ�����������
A���٢ڢ� B���ܢ�
C���٢� D���٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д�ɻ�ѧ����ʽ��ȷ���ǣ� ��
A.Zn2++2OH���TZn��OH��2��? ZnCO3+2NaOH�TZn��OH��2��+Na2CO3
B.Ba2++SO ![]() �TBaSO4��????? Ba��OH��2+H2SO4�TBaSO4��+2H2O
�TBaSO4��????? Ba��OH��2+H2SO4�TBaSO4��+2H2O
C.Ag++Cl���TAgCl��????? AgNO3+KCl�TAgCl��+KNO3
D.Cu+2Ag+�TCu2++2Ag???? Cu+2AgCl�TCuCl2+2Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KClO3+6HCl=KCl+3Cl2��+3H2O��Ӧ�У�������0.5molCl2ʱ����������ͻ�ԭ��������ʵ���֮��Ϊ( )
A.6��1B.5��1C.1��3D.1��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.Ħ����һ�ֹ��ʻ���������
B.��ͬ��ͬѹ�£���ͬ������κ����嵥��������������ͬ
C.��״��������Ħ�����ԼΪ22.4 L
D.1 mol��������Ϊ16 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com