
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选 项 | ① | ② | ③ | 实验结论 |
|
| A. | 稀 硫 酸 | Na2S | AgNO3与 AgCl的 浊液 | Ksp(AgCl)> Ksp(Ag2S) | |
| B. | 浓 硫 酸 | 蔗糖 | 溴水 | 浓硫酸具有脱 水性、氧化性 | |
| C. | 稀 盐 酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性 钡盐均可生成 白色沉淀 | |
| D. | 浓 硝 酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸> 碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
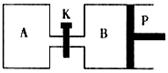
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8--8.0,酸色—红色,碱色—黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出A管中发生的反应: ;
(3)写出B管中发生的反应: ;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g) 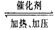 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是 (填“吸热”或“放热”)反应。
②500℃达平衡时,CH3OH的体积分数为 。
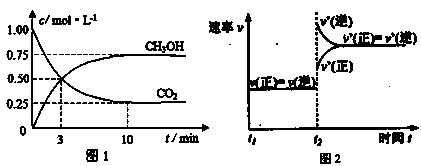
 (2)右图中P是可自由平行滑动的活塞,关闭K,在
(2)右图中P是可自由平行滑动的活塞,关闭K,在
相同温度时,向A容器中充入
1molCH3OH(g)和2molH2O(g),向B容器中充入
1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,
容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时
间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,
且不考虑温度的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有些化学实验操作的“先”与“后”,对化学实验结果或安全具有十分重要的意义。下列对实验操作“先”与“后”的设计中,正确的是( )。
A.制备气体前,先往装置中装入药品,后检查装置的气密性
B.稀释浓硫酸时,先往容器中装水,后慢慢倒入浓硫酸并不断搅拌
C.测定溶液的酸碱度时,先将pH试纸用水润湿,后沾上被测溶液
D.做一氧化碳还原氧化铁的实验时,先加热、后通一氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )。
A.1.8 g的NH4+离子中含有的电子数为NA
B.常温常压下,11.2 L氧气所含的原子数为NA
C.常温常压下,48 g O3和O2的混合物含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
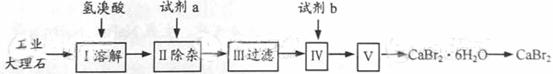
完成下列填空:
35.上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
36.已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
37.试剂b是 ,步骤Ⅳ的目的是 。
38.步骤Ⅴ所含的操作依次是 、 。
39.制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com