
【题目】用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术,发生如下反应:
①![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g) ![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
下列说法错误的是 ( )
A. 反应①达到平衡时,增大压强平衡不移动
B. 反应②的平衡常数表达式为K=![]()
C. 反应①和②是主反应,反应③是副反应
D. 2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
【答案】C
【解析】A、反应①是前后气体体积不变的反应,改变压强平衡不移动,不影响化学平衡,故A正确;B、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,注意固体和纯液体浓度是定值,不写入平衡常数表达式,反应②的平衡常数表达式为K=![]() ,故B正确;C、用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术,反应①是主反应,反应②③是副反应,故C错误;D、①
,故B正确;C、用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术,反应①是主反应,反应②③是副反应,故C错误;D、①![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1;②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1;③CO(g)
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1;②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1;③CO(g) ![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1,①×4+②+③×2得到:2CaSO4(s)+7CO(g)
CO2(g) ΔH3=-86.2 kJ·mol-1,①×4+②+③×2得到:2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g) △H=--151.1KJ·mol-1,反应是放热反应,故D正确;故选C。
CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g) △H=--151.1KJ·mol-1,反应是放热反应,故D正确;故选C。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下:
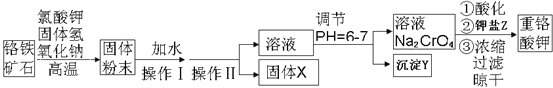
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有_________。铁在周期表的位置是_________。
(2)煅烧前应将铬铁矿充分粉碎,其目的是___________________________。
如在实验室中将铬铁矿和NaOH固体混合物灼烧,从以下各实验仪器中选择必要有_________。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角
(3)操作Ⅱ的名称是__________________。
(4)固体X的主要成分是__________________,沉淀Y的主要成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质.当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用.
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的结构式为 .
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为(已知该反应为置换反应),Fe2O3还可用于“铝热法”炼铁,铝热反应在冶金工业上可用于
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,Na2O的电子式为 .
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)![]() 2H2O(l) △H=571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
2H2O(l) △H=571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
B.已知C(石墨,s)![]() C(金刚石,s) △H>0 ,则金刚石比石墨稳定
C(金刚石,s) △H>0 ,则金刚石比石墨稳定
C.含20.0 gNaOH稀溶液与稀盐酸完全中和,放出28.7 kJ热量,则稀醋酸和稀NaOH溶液反应热化学方程式为NaOH(aq) + CH3COOH(aq)![]() CH3COONa(aq) + H2O(1) △H=57.4 kJ/mol
CH3COONa(aq) + H2O(1) △H=57.4 kJ/mol
D.已知2C(s)+2O2(g)![]() 2CO2(g) △H1;2C(s)+O2(g)
2CO2(g) △H1;2C(s)+O2(g)![]() 2CO(g) △H2,则△H1>△H2
2CO(g) △H2,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2X(g)+Y(g)![]() aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是

A. 图甲,P1>P2,a < 3
B. 图甲,T1<T2,Q>0
C. 图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D. 图乙,如果a=3, t2时表示向体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为:

在T℃时,向2.0 L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是 ( )
A. 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol·L-1·min-1
B. 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH<0
C. 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 mol α-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行
D. 在T℃时,起始时若向容器中充入2.0mol α-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的位置如表所示.下列说法不正确的是( ) 
A.甲、丁、戊的单质都是金属
B.乙、丙、辛都是非金属元素
C.乙、庚、辛都能形成氧化物
D.已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中c(CH3COOH)/c(H+)值减小
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com