
【题目】在一定温度下,把3.0molM和2.5mol N混合于2.0L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g) ![]() XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,己知Q的平均反应速率为0.01mol·L-1·min-1,下列说法错误的是( )
XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,己知Q的平均反应速率为0.01mol·L-1·min-1,下列说法错误的是( )
A. X的值为1 B. M的平均反应速率为0.15 molL-1·min-1
C. M的转化率为60% D. 平衡时P的浓度为0.25 molL-1
【答案】C
【解析】A项,因为5min后反应达到平衡,容器内的压强变小,所以该反应是气体分子数减小的反应,故X=1,A正确;B项,B项,Q的平均反应速率为0.1molL-1min-1,速率之比=化学计量数之比,所以M的平均反应速率为0.15 molL-1min-1,B正确;C项,5min内反应的M为0.15 molL-1min-1×5min×2L=1.5 mol,故转化率为50%,C错误;D项,Q的平均反应速率为0.1molL-1min-1,速率之比=化学计量数之比,所以P的平均反应速率为0.05 molL-1min-1,故平衡时P的浓度为0.05 molL-1min-1×5min=0.25 molL-1,D正确。


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】麻黄素是中枢神经兴奋剂,其合成路线如下图所示。其中A为烃,相对分子质量为92,NHS是一种选择性溴代试剂。

已知:
(1)A的结构简式是______________,E中含氧官能团的名称为______________。
(2)反应B→C的反应条件和试剂是______________,D的结构简式为_______________。
(3)写出反应④的化学方程式_________________。
(4) F的同分异构体中能同时满足下列条件的共有_____种(不含立体异构):
①含有苯环 ②能与饱和NaHCO3溶液反应其中核磁共振氢谱为5组峰,且峰面积为3:2:2:2:1的物质的结构简式为____________(任写一种)。F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填字母)。
a.质谱仪 b.红外光谱仪 c.核磁共振仪 d.元素分析仪
(5)请仿照题中流程图合成路线,设计以乙醛为起始主要原料合成强吸水性树脂的合成路线 ,___________其他试剂任选。
,___________其他试剂任选。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面配制500mL 0.1 mol/L的NaOH溶液的说法正确的是( )
A. 应先用称量纸在托盘天平上称取NaOH固体2g。
B. 定容时若仰视刻度线,会使所配NaOH溶液的浓度偏高。
C. 容量瓶应预先检漏并洗涤干净,但不需干燥,容量瓶中的少量水无影响。
D. 称好的NaOH固体应先放在烧杯中溶解,溶解完全后应立即转移至容量瓶中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是

A. HR为强电解质
B. 图中四点,水的电离程度:c>b>d>a
C. 若常温时0.1mol/LHR溶液的电离度为1%,则常温时R-的水解常数约为10-9
D. b点溶液中存在c(Na+)=c(R-)+c(HR)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种常见的强氧化剂,能氧化硫酸亚铁、盐酸等物质。某兴趣小组模拟企业处理含铬废水(主要含Cr2O72-和Cr3+),同时获得重铬酸钾晶体的流程如下:
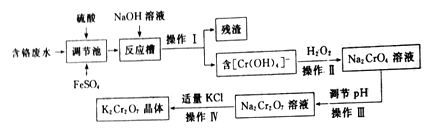
回答下列问题:
(1)操作I是______,残渣的主要成分是______。
(2)调节池中发生的主要反应的离子方程式为__________________。
(3)操作Ⅲ__________(填“能”或“不能”)用盐酸调节溶液pH,原因是___________。
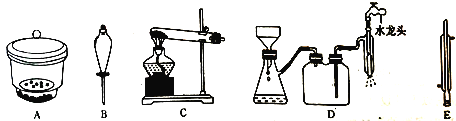
(4)从Na2Cr2O7溶液中获得K2Cr2O7晶体的操作依次是加入适量KCl固体,搅拌、溶解,在水浴上加热浓缩至________时停止加热。接下来获得K2Cr2O7晶体需要的一系列操作中,下列仪器可能会用到的是__________(填标号)。
(5)为检测处理后废水是否达到排放标准,某同学进行了如下实验:取100mL处理后的废液样品于锥形瓶中,用浓醋酸调节pH=5并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr2+,再用cmol· L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr3++Y4-=CrY-,若实验消耗EDTA标准溶液VmL,则处理后的废液中含铬元素浓度为______mg·L-1(用含c、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件己略去) ( )

A. 只有反应①②④均属于氧化还原反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)实验需要的玻璃仪器除了烧杯、胶头滴管、量筒、玻璃棒,还有__________________
(2)计算:98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为______,配制本次实验需要的稀硫酸需用量筒量取上述98%的浓H2SO4___________________ mL
(3)配制过程:①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀
⑤向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用胶头滴管加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦将配制好的溶液转移至试剂瓶中待用。
上述配置溶液的步骤存在缺失,缺少的步骤是_____________________,应放在步骤_____之前进行(填“序号”)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中______
②量取浓硫酸所用量筒有蒸馏水______
③定容时,俯视液面______.
④用量筒量取浓硫酸时仰视液面________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组进行下面实验探究,查阅资料知道:
①2NO+Na2O2=2NaNO2
②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣被还原成Mn2+。
Ⅰ.产品制备与检验:用图20装置制备NaNO2
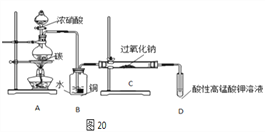
(1)写出装置A烧瓶中发生反应的化学方程式________________。
(2)B装置的作用是___________;盛浓硝酸的仪器名称为__________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净的NaNO2,应在B、C装置间增加一个干燥管。在干燥管中盛放的试剂名称为____________。
(4)请设计实验,检验装置C中NaNO2的存在(写出操作、现象和结论)_________。
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是_________。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束后仰视读数
D.滴定结束后俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com