
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
②2CO(g)+O2(g) =2CO2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g) △H= 。
CH3OH(g) △H= 。
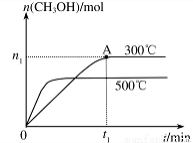
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
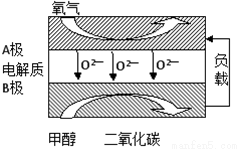
①B极的电极反应式为 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀 (填“能”或“否”)。
(1)△H1+1/2△H2 -1/2△H3
(2 <
(3)ABE
(4)6.75
(5)① CH3OH+3O2-6e-= CO2+ 2H2O;
②甲醇不完全被氧化,生成C或CO 或电池能量转化率达不到100%
(6)否
【解析】(1)①+1/2②—1/2③。整理可得:CO(g)+ 2H2(g) CH3OH(g)△H=△H1+1/2△H2 -1/2△H3。
CH3OH(g)△H=△H1+1/2△H2 -1/2△H3。
(2)由图像可以看出:升高温度,平衡时CH3OH的含量降低,说明升高温度,化学平衡向逆反应方向移动,根据平衡移动原理,升高温度化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应。因此△H<0。
(3)若要提高甲醇的产率,应该使平衡正向移动。由于该反应的正反应为气体体积缩小的放热反应,根据平衡移动原理,降低温度、增大压强(即缩小容器体积)增大反应物的浓度或把甲醇从反应体系中分离出来。因此选项为A、B、E。
(4)根据反应方程式CH4+H2O CO+3H2中各种物质的相互关系及甲烷的转化率可知:当反应达到平衡时,c(CH4)=0.5mol/L;c(H2O)=0.5mol/L;c(CO)=0.5mol/L;c(H2)=1.5mol/L.化学平衡状态是可逆反应达到平衡状态时,各种生成物浓度幂指数的乘积一各种反应物浓度幂指数乘积的比,所以
CO+3H2中各种物质的相互关系及甲烷的转化率可知:当反应达到平衡时,c(CH4)=0.5mol/L;c(H2O)=0.5mol/L;c(CO)=0.5mol/L;c(H2)=1.5mol/L.化学平衡状态是可逆反应达到平衡状态时,各种生成物浓度幂指数的乘积一各种反应物浓度幂指数乘积的比,所以
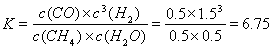 。
。
(5)①通入甲醇的电极B为原电池的负极, B极的电极反应式为CH3OH + 3O2-6e-= CO2+ 2H2O; 通入氧气的电极为正极,正极发生反应:O2+ 4e-= 2O2-。
②当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是甲醇不完全被氧化,生成C或CO或电池能量转化率达不到100%等。
(6)碳酸钙的Ksp=2.5×10-9,则c(Ca2+)·c(CO32-)=Ksp, c(Ca2+)=Ksp1/2=(2.5×10-9)1/2=5×10-5,当向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml 时,c(Ca2+)·c(C2O42-)=(1/2×5×10-5) ×(1/2×8.0×10-4)=10-8,小于草酸钙的Ksp=4.0×10-8,所以不能产生草酸钙沉淀。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2014高考名师推荐化学Vm与它的推论应用(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.1 mol Al3+离子含有的核外电子数为3NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子 | NO | SO42- | H+ | M |
浓度(mol·L-1) | 2 | 1 | 2 | 1 |
A.Mg2+ B.Ba2+ C.F- D.Na+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态
C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍
D.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
下列实验操作、现象和解释都正确的是
选项 | 实验操作 | 现象 | 解释 |
A | 在密闭容器中加热CuO | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列说法正确的是
A石油经过分馏及裂化等工序得到的物质均为纯净物
B乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应
C乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D苯不能使酸性高锰酸钾溶液银色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列分类正确的是
A.共价化合物:硫酸、水、纯碱
B. 非电解质:乙醇、二氧化碳、氨气
C. 胶体:饱和氯化铁溶液、豆浆、牛奶
D.硅酸盐产品:水晶、玻璃、陶瓷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)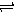 Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C.其他条件不 变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com