
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
I 、金属Ca 的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca + H2=CaH2(固体)。
II 、固体CaH2的部分性质有:
① 常温:CaH2+ 2H2O = Ca(OH)2+2H2;②CaH2要密封保存。
(l)写出Ca常温遇水立即发生反应的化学方程式:_________;其中氧化剂为_________(填化学式)。
(2)用双线桥法标明反应CaH2+ 2H2O = Ca(OH)2+2H2中电子转移的方向和数目________________。
(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,如果不考虑中间的损失,理论上两份产生的氢气的物质的量比为________。
【答案】 Ca + 2H2O=Ca(OH)2 + H2↑ H2O 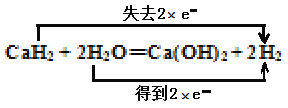 1:2
1:2
【解析】(1)Ca常温遇水发生反应生成氢氧化钙和氢气,化学方程式:Ca + 2H2O=Ca(OH)2 + H2↑;反应物水中氢元素由+1价降为0价,作氧化剂;(2)该反应中H元素化合价由+1价变为0价、H元素化合价由-1价变为0价,其得失电子最小公倍数是2,其电子转移的方向和数目为用双线桥法标明反应:CaH2+ 2H2O = Ca(OH)2+2H2中电子转移的方向和数目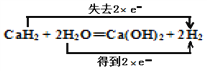 ;(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,1molCa与得到1molH2,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,1molCaH2得到2molH2,不考虑中间的损失,理论上两份产生的氢气的物质的量比为1:2。
;(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,1molCa与得到1molH2,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,1molCaH2得到2molH2,不考虑中间的损失,理论上两份产生的氢气的物质的量比为1:2。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将0.1molCl2通入一定量水中,HClO、Cl-、ClO-粒子数之和为0.2NA
B. 12gNaHSO4固体中含阳离子数为0.1NA
C. 将1molFe(OH)3加入到含3molHI的溶液完全反应后,溶液中所含I- 的数目为3NA
D. 已知合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子时,反应放出的热量大于46.2kJ
2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子时,反应放出的热量大于46.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 向汽油中添加甲醇后,该混合燃料的热值不变
B. 光催化还原水制氢比电解水制氢更节能环保、更经济
C. 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
D. 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)写出B2O3与NH3反应生成BN的方程式___________________________
(2)基态N原子的价层电子排布式为_________。
(3)B、N、O相比,第一电离能最大的是_______,BN中B元素的化合价为_____
(4)SO42–中S原子的杂化轨道类型为_______,O—S—O的键角是_______,写出一个与SO42–等电子体的微粒_______。
(5)BF3能与NH3反应生成BF3NH3,BF3分子的分子构型为_______,BF3NH3中BF3与NH3之间通过___________(填“离子键”、“ 配位键”或“氢键”) 结合。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某加碘食盐包装袋上的配料表和部分图表文字(I为碘的元素符号)

(1)由此得到的信息和作出的推测正确的是_______________
A.此食盐是非电解质
B. “菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
C. 1 kg 此食盐中含碘酸钾(35±15 ) mg
D. “加碘食盐”中的“碘”是指碘单质
E.在食盐中不加入KI的原因可能是能被氧化
(2)已知碘元素最高和最低价分别为一1和+7价,则IO3-在氧化还原中____________(填序号)。
①只能做氧化剂 ② 只能做还原剂 ③ 既可以做氧化剂也可以做还原剂
(3)根据以下化学方程式写出离子方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O__________________;该反应中氧化产物和还原产物的质量比为_________;若生成152.4gI2,转移的电子数为_________;根据以上反应推测,一个氧化还原反应的发生,除了跟物质的氧化性和还原性有关,还和____________有关。
(4)要利用(3)提供的反应原理检验食盐中的碘元素,采用下列方法:
①反应后加入________溶液,溶液变蓝;
②反应后溶液放入试管中加入少量CC14 震荡后静置,若下层显_______色,证明有I2生成。
③ 家庭条件下证明在食盐中存在IO3-进行上述实验时必须使用的物质是________。
a.自来水 b.蓝色石蕊试纸 c.碘化钾淀粉试纸 d.淀粉 e.食糖 f.食醋 g.白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯可用下图所示装置。请回答下列问题
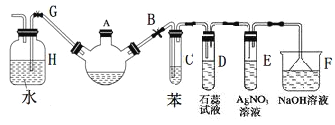
(1)关闭G夹,打开B夹,从装有少量苯的三颈烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为_________________________________。
(2)试管C中苯的作用是:____________________。试管D中出现的现象是:_____________。试管E中出现的现象是:___________________。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开G夹,关闭B夹,可以看到的现象是_______________ 。
(4)三颈烧瓶中的溴苯经过下列步骤分离提纯:
①向三颈烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是__________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______。
④经过上述分离操作后,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:
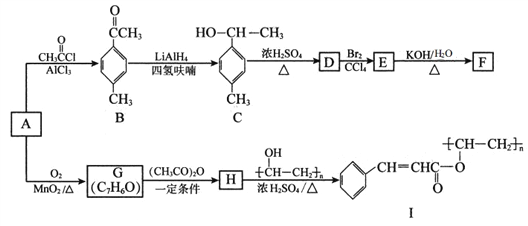
(1)A的分子式为____________,上述八个反应中,属于取代反应的共有_______个。
(2) D的名称为____________________,G分子中最多有_________个原子共面。
(3)由H生成I的化学方程式为_____________________________________________。
(4)符合下列条件的B的同分异构体有____________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是_________(写出其中一种的结构简式)。
①属于芳香化合物;②能发生银镜反应。
(5)己知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备 ![]() 的合成路线___________________________________。
的合成路线___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com