
【题目】TiO2在工业生产和日常生活中有重要用途.
(1)工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得: 
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
A.H2O2 B.KMnO4 C.KOH D.SO2
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
【答案】
(1)Al2O3+2OH﹣=2AlO2﹣+H2O;A;除去亚铁离子;TiOSO4+3H2O=TiO22H2O↓+H2SO4
(2)TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti);碳单质会与阳极产生的氧气反应而不断减少
【解析】解:钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH﹣=2AlO2﹣+H2O、SiO2+2OH﹣=SiO32﹣+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K﹣353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4 , 加入X并调节溶液的pH得到沉淀和TiO2+、SO42﹣ , 说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42﹣加热、过滤得到TiO2.2H2O,焙烧得到TiO2;(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水,离子反应方程式为Al2O3+2OH﹣=2AlO2﹣+H2O,
故答案为:Al2O3+2OH﹣=2AlO2﹣+H2O;(2)④X应该具有强氧化性,且不能引进杂质,具有氧化性的是双氧水和高锰酸钾溶液,但高锰酸钾溶液氧化亚铁离子时引进新的杂质,故选A;(3)④⑤两步的目的是除去亚铁离子,防止制得的二氧化钛中含有杂质,故答案为:除去亚铁离子;(4)⑥中TiO2+水解生成TiO2.2H2O,反应方程式为TiOSO4+3H2O=TiO22H2O↓+H2SO4 ,
故答案为:TiOSO4+3H2O=TiO22H2O↓+H2SO4;(5)TiO2与Cl2、C反应得到TiCl4 , 同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁,则生成四氯化钛的反应方程式为TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO,
故答案为:TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;(6)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti),
故答案为:TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti);(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳,
故答案为:碳单质会与阳极产生的氧气反应而不断减少.
钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH﹣=2AlO2﹣+H2O、
SiO2+2OH﹣=SiO32﹣+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K﹣353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4 , 加入X并调节溶液的pH得到沉淀和TiO2+、SO42﹣ , 说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42﹣加热、过滤得到TiO2.2H2O,焙烧得到TiO2;(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水;(2)④X应该具有强氧化性,且不能引进杂质;(3)④⑤两步的目的是除去亚铁离子;(4)⑥中TiO2+水解生成TiO2.2H2O;(5)TiO2与Cl2、C反应得到TiCl4 , 同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁;(6)阴极上得电子反应还原反应生成金属钛;(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳.


科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律. 
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.在化学反应中,强酸一般能制取弱酸.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择所给试剂,用如上图装置来证明酸性:HNO3>H2CO3>H2SiO3 . (不考虑硝酸的挥发性)A、B、C中盛有的试剂分别为、、 . C中实验现象为;
写出C中发生反应的离子方程式: .
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用上图装置证明氯气氧化性强于碘单质的氧化性.A中盛装浓盐酸,B中装入高锰酸钾粉末,实验时C中溶液变成蓝色,则:C中盛装的试剂为;写出C中离子方程式 . 该实验装置有明显不足,请指出改进方法: .
(3)如果C中盛装饱和的氢硫酸(H2S饱和水溶液),A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出该反应的化学方程式:;如果将SO2气体通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2(填序号). A.漂白性 B.氧化性 C.还原性 D.酸性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W,X不可能是( )
选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
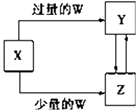
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为 . 当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为g. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.6mol,这些气体恰好能被500mL 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( )
A.0.2mol
B.0.6mol
C.0.8mol
D.1.0mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ
B.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D.己知C(s)+O2 (g)=CO2(g);△H1? 2C(s)+O2(g)=2CO(g);△H2????? 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构为: 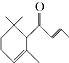 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A.分子式为C13H20O
B.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2
D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com