
【题目】某气态烃A 与 H2的相对密度为14,其产量可以用来衡量一个国家的石油化工发展水平。以该化合物为原枓合成化合物G、E和I的流程如下:
已知:Ⅰ.芳香族化合物F为C、H、O化合物,其相对分子质量为166,环上的一氯代物有一种,1 mol F与足量NaHCO3溶液反应能生成2 mol CO2,F与足量B反应生成G。
Ⅱ.H为二元醇,其蒸气密度折算成标准状况为2.77 g/L,H与足量D反应生成I。

(1)A的电子式为____________________,E的结构简式____________________________________。
(2)G的分子式为______________,反应⑤的反应类型为________________。
(3)写出下列化学方程式:
②__________________________________________________________________;
⑥_______________________________________________________________;
【答案】 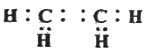 CH3COOCH2CH3 C12H14O4 酯化反应 2CH3CH2OH+O2
CH3COOCH2CH3 C12H14O4 酯化反应 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O 2CH3COOH + HOCH2CH2OH
2CH3CHO + 2H2O 2CH3COOH + HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3 + 2H2O
CH3COOCH2CH2OOCCH3 + 2H2O
【解析】某气态烃A与H2的相对密度为14,该气体的相对分子质量为28,其产量可以用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,C进一步发生氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3;芳香族化合物F为C、H、O化合物,1mol F与足量NaHCO3溶液反应能生成2mol CO2,则F含有2个羧基,其相对分子质量为166,2个羧基、1个C6H4的总式量为45×2+(12×6+4)=166,则F含有1个苯环、2个羧基,且环上的一氯代物有一种,则F为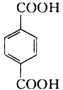 ,F与足量的B发生酯化反应生成G为
,F与足量的B发生酯化反应生成G为![]() ,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为
,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为![]() ,则
,则
(1)A是乙烯,电子式为![]() ,E的结构简式CH3COOCH2CH3。(2)G为
,E的结构简式CH3COOCH2CH3。(2)G为![]() ,分子式为C12H14O4,反应⑤的反应类型为酯化反应或取代反应;(3)②为乙醇的催化氧化,反应方程式为2CH3CH2OH+O2
,分子式为C12H14O4,反应⑤的反应类型为酯化反应或取代反应;(3)②为乙醇的催化氧化,反应方程式为2CH3CH2OH+O2![]() 2CH3CHO + 2H2O;反应⑥的化学方程式为:2CH3COOH + HOCH2CH2OH
2CH3CHO + 2H2O;反应⑥的化学方程式为:2CH3COOH + HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3 + 2H2O。
CH3COOCH2CH2OOCCH3 + 2H2O。


科目:高中化学 来源: 题型:
【题目】日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3 +3O2 =2CO2 +3H2O ,电池示意如图,下列说法不正确的是
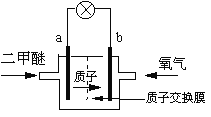
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ +O2+4e- = 2H2O
D.电池工作时,1 mol二甲醚被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关蛋白质中肽键的叙述,错误的是
A. 核糖体是合成肽键的场所
B. 蛋白质中的N主要存在于肽键中
C. 肽键的结构式可表示为NH—CO
D. 双缩脲试剂可与肽键作用生成紫色物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:

步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
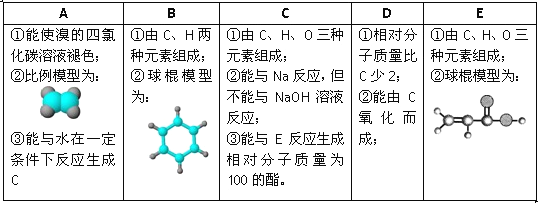
根据表中信息回答下列问题:
(1)A到E中,属于烃的是_______(填字母);写出A与溴水反应的化学方程式_____________。
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式_______。当n=________时,这类有机物开始出现同分异构体。
(3)B具有的性质是_____________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应⑥可使酸性高锰酸钾溶液和溴水均褪色
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:_________________。
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为_____________;其化学方程式为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱饮料,由于此饮料中含有Fe2+ , 现榨的苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
A.氧化性
B.还原性
C.碱性
D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式____________。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
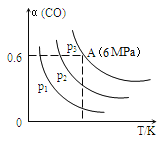
①p1、p2、p3中最大的是________。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为____mol·L-1·min-1。
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性______(填“减弱”、“增强”或“不变”),Y电极是_____极,写出X电极上发生的电极反应式__________。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为_____L(标准状况下)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com