
【题目】已知常温下,K![]() ,K
,K![]() ,下列叙述正确的是
,下列叙述正确的是
A.常温下,AgCl在饱和NaCl溶液中的 K![]() 比在纯水中的 K
比在纯水中的 K![]() 小
小
B.向AgCl的悬浊液中加入![]() 溶液,沉淀由白色转化为黄色
溶液,沉淀由白色转化为黄色
C.将![]() 的
的![]() 溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中 c![]() c
c![]()
科目:高中化学 来源: 题型:
【题目】常温下,取20 mL某浓度的盐酸作为待测液,用-定物质的量浓度的NaOH溶液进行滴定(溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示。下列叙述不正确的是( )
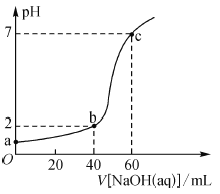
A.盐酸与NaOH溶液初始浓度关系为c(HCl)-2c(NaOH)=0.03mol·L-1
B.b点溶液中:c(Cl-)>c(Na+)>c(H+)>c(OH-)
C.a、b、c点溶液中水的电离程度大小依次为:a>b>c
D.滴定前,锥形瓶用待测液润洗,会导致所测HCl浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的X、Y、Z三种酸的水溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积
的X、Y、Z三种酸的水溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积![]() 的关系如图所示,X、Z不为平行线。则下列说法正确的是
的关系如图所示,X、Z不为平行线。则下列说法正确的是

A.原溶液都是稀溶液
B.原溶液的浓度大小为![]()
C.Z是强酸,Y和X是弱酸
D.![]() 溶液中微粒浓度
溶液中微粒浓度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() ,
,![]() 。下列关于难溶物之间转化的说法中错误的是
。下列关于难溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的![]() 相差越大,难溶物就越容易转化为更难溶的物质
相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11
×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
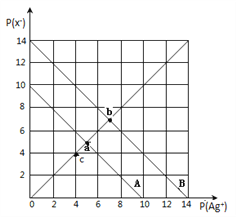
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是![]()
A.原子半径:![]()
B.标准状况下的![]() LM溶于水,所得溶液
LM溶于水,所得溶液![]()
C.![]() 能使湿润的淀粉KI试纸变蓝
能使湿润的淀粉KI试纸变蓝
D.一定条件下,Cu可与W的最高价氧化物对应水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
A.C(Na+)>C(CN-)>C( H+)>C(OH-)
B.C(HCN)+C (CN-)=0.04mol·L-1
C.C(CN-)>C(HCN)
D.C(Na+)+C(H+)= C(CN-)+C(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98kJ·mol-1。某温度下该反应的平衡常数K=
SO3(g) △H=-98kJ·mol-1。某温度下该反应的平衡常数K=![]() 。
。
(1)该温度下,向100 L的恒容密闭容器中,充入3.0molSO2(g)、16.0molO2(g)和3.0molSO3(g),则反应开始时v(正)__v(逆)(填“<”、“>”或“=”)。
(2)该温度下,向一体积为2L的恒容密闭容器中充入2.0molSO2和1.0molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为___。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
A.保持温度和容器体积不变,充入1.0molO2
B.升高温度
C.保持温度和容器体积不变,充入1.0molSO3
D.增大容器体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com