
【题目】常温下,取20 mL某浓度的盐酸作为待测液,用-定物质的量浓度的NaOH溶液进行滴定(溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示。下列叙述不正确的是( )
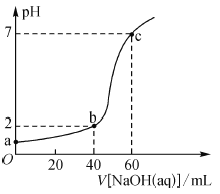
A.盐酸与NaOH溶液初始浓度关系为c(HCl)-2c(NaOH)=0.03mol·L-1
B.b点溶液中:c(Cl-)>c(Na+)>c(H+)>c(OH-)
C.a、b、c点溶液中水的电离程度大小依次为:a>b>c
D.滴定前,锥形瓶用待测液润洗,会导致所测HCl浓度偏高
【答案】C
【解析】
A. 设盐酸和氢氧化钠的物质的量浓度,根据图象数据列式计算;
B. b点溶液pH=2,溶液呈酸性,c(H+)>c(OH-),结合电荷守恒进行分析;
C. a、b两点为酸性溶液,抑制了水的电离,氢离子浓度越大,水的电离程度越小,c点为中性,据此分析判断;
D. 锥形瓶润洗后,待测液物质的量偏大,消耗的标准液的体积偏大。
A. 设起始时HCl的浓度为xmol/L,NaOH溶液浓度为ymol/L,根据图象可得20×10-3x=60×10-3y,20×10-3x -40×10-3y=0.01×(20+40)×10-3,解得x=0.09,y=0.03,因此c(HCl)-2c(NaOH)=0.03mol·L-1,A项正确;
B. b点加入40mLNaOH溶液,盐酸过量,溶液显酸性,c(H+)>c(OH-),此时得到的溶液中c(NaCl)=2c(HCl),溶液中电荷守恒为c(H+)+ c(Na+)=c(OH-)+c(Cl-),则c(H+)<c(Na+)<c(Cl-),因此溶液中离子浓度的大小关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-),B项正确;
C. a、b两点为酸性溶液,抑制了水的电离,氢离子浓度越大,水的电离程度越小,c点为中性,因此溶液中水的电离程度大小依次为c>b>a,C项错误;
D. 锥形瓶用待测液润洗后,待测液物质的量偏大,消耗的标准液的体积偏大,测定的HCl浓度偏高,D项正确;
答案选C。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法不正确的是
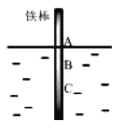
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-=4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.Na2S 溶液的水解:S2-+ 2H2O ![]() H2S + 2OH-
H2S + 2OH-
B.NaHCO3 溶液的电离:HCO3-+ H2O ![]() H2CO3+ OH-
H2CO3+ OH-
C.NH4Cl 溶液的水解:NH4++ H2O ![]() NH3·H2O+ H+
NH3·H2O+ H+
D.水溶液中的 NaHSO4 电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g) ![]() C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )
C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )

A.图中虚线表示加入了催化剂
B.图中虚线表示的反应I、反应II均为放热反应
C.加入催化剂,速率加快是因为改变了反应的焓变
D.该反应的焓变△H=-91kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中学常见实验的现象或表述正确的是![]()
A.饱和碳酸钠溶液和饱和碳酸氢钠溶液中滴入酚酞溶液,溶液均显红色
B.含4molHCl的浓盐酸与足量的![]() 共热,得到
共热,得到![]()
C.铝箔在空气中用酒精灯加热可以熔化滴落,且发生剧烈燃烧
D.![]() 和
和![]() 的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是
的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是___(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能 e.天然气 f.氢能
(2)甲烷裂解法制取乙炔反应的化学方程式为2CH4(g)![]() C2H2(g)+3H2(g)。
C2H2(g)+3H2(g)。
①已知下列化学键的键能数据:
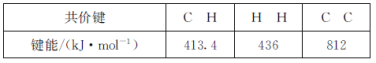
则反应2CH4(g)![]() C2H2(g)+3H2(g)的△H=___kJ·mol-1。
C2H2(g)+3H2(g)的△H=___kJ·mol-1。
②燃烧agCH4生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则CH4(g)+2O2(g)![]() CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨的稳定性较大的是___(填“金刚石”或“石墨”);石墨的燃烧热为___kJ·mol-1。
②12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为___kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为![]()
![]() 溶液和HCN溶液的pH分别为m和
溶液和HCN溶液的pH分别为m和![]() 下列叙述中错误的是
下列叙述中错误的是
A.常温下,pH相同的![]() 溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化较小
溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化较小
B.等温下,等浓度的![]() 和HCN溶液pH,后者大
和HCN溶液pH,后者大
C.HCN溶液和NaOH不等体积混合后一定存在如下关系![]()
D.![]() 和HCN溶液中由水电离出的
和HCN溶液中由水电离出的![]() ,前者是后者的
,前者是后者的![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,K![]() ,K
,K![]() ,下列叙述正确的是
,下列叙述正确的是
A.常温下,AgCl在饱和NaCl溶液中的 K![]() 比在纯水中的 K
比在纯水中的 K![]() 小
小
B.向AgCl的悬浊液中加入![]() 溶液,沉淀由白色转化为黄色
溶液,沉淀由白色转化为黄色
C.将![]() 的
的![]() 溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中 c![]() c
c![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com