
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是___(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能 e.天然气 f.氢能
(2)甲烷裂解法制取乙炔反应的化学方程式为2CH4(g)![]() C2H2(g)+3H2(g)。
C2H2(g)+3H2(g)。
①已知下列化学键的键能数据:
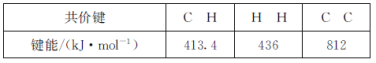
则反应2CH4(g)![]() C2H2(g)+3H2(g)的△H=___kJ·mol-1。
C2H2(g)+3H2(g)的△H=___kJ·mol-1。
②燃烧agCH4生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则CH4(g)+2O2(g)![]() CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨的稳定性较大的是___(填“金刚石”或“石墨”);石墨的燃烧热为___kJ·mol-1。
②12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为___kJ。
【答案】ae +360.4 -890 0.8 石墨 393.5 252.0
【解析】
(1)新能源是指无污染、可以持续利用的能源,包括太阳能、风能、核能、地热能、潮汐能等;
(2)①根据△H=反应物的总键能-生成物的总键能进行计算;
②agCH4生成二氧化碳气体和液态水,放出热量44.5kJ,根据生成沉淀的质量计算出CO2的物质的量,进一步计算出agCH4的物质的量,最终计算1molCH4生成二氧化碳气体和液态水,放出的热量;
(3)①能量越低物质越稳定;1mol纯物质完全燃烧生成稳定氧化物时释放的能量为燃烧热;
②根据极值计算判断生成的气体的组成,结合热化学方程式计算。
(1)根据分析可知,太阳能、风能、地热能、氢能都是新能源,因此不属于新能源的是煤炭和天然气,答案选ae;
(2)①△H=反应物的总键能-生成物的总键=2×4×413.4kJ/mol-2×413.4kJ/mol-812kJ/mol-3×436kJ/mol=+360.4 kJ·mol-1;
②agCH4生成二氧化碳气体和液态水,生成的CO2与足量澄清石灰水反应得到5g沉淀,那么n(CaCO3)=n(CO2)=n(CH4)=![]() =0.05mol,即0.05mol(a=0.05mol×16g/mol=0.8g) CH4生成二氧化碳气体和液态水,放出热量44.5kJ,因此1mol CH4生成二氧化碳气体和液态水,放出热量
=0.05mol,即0.05mol(a=0.05mol×16g/mol=0.8g) CH4生成二氧化碳气体和液态水,放出热量44.5kJ,因此1mol CH4生成二氧化碳气体和液态水,放出热量![]() kJ=890 kJ,即CH4(g)+2O2(g) = CO2(g)+2H2O(l)△H1=-890kJ·mol-1,a=0.8;
kJ=890 kJ,即CH4(g)+2O2(g) = CO2(g)+2H2O(l)△H1=-890kJ·mol-1,a=0.8;
(3)①能量越低物质越稳定,由图象可知金刚石的能量高于石墨的能量,因此石金刚石和石墨中稳定性较大的是石墨;1mol石墨完全燃烧生成CO2放出的热量为110.5kJ+283.0kJ=393.5 kJ,因此石墨的燃烧热是393.5 kJ·mol-1
②12g石墨的物质的量为1mol,在一定量的空气中燃烧,根据元素守恒,若生成CO2,质量为44g,若生成CO,质量为28g,现生成的气体为36g,28g<36g<44g,说明生成的气体既有CO又有CO2,设生成的CO为xmol,生成的CO2为(1-x)mol,28x+44(1-x)=36,x=0.5mol,即生成的CO为0.5mol,CO2为0.5mol;1mol石墨燃烧生成CO放出的热量为110.5 kJ,那么0.5mol石墨燃烧生成CO放出的热量为55.25kJ,1mol石墨完全燃烧生成CO2放出的热量为393.5 kJ,那么0.5mol石墨完全燃烧生成CO2放出的热量为196.75 kJ,所以12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为55.25kJ+196.75kJ=252.0 kJ。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________。
(2)尿素水解液呈碱性,则c(![]() )___________ c(
)___________ c(![]() )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成![]() 的离子方程式为___________。
的离子方程式为___________。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
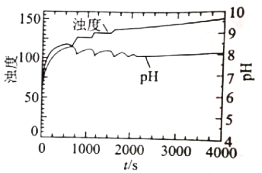
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.若向容器中充入惰性气体,则平衡向右移动
D.物质A一定为非气态,且正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H1
H2O(g) △H1
![]() N2(g)+O2(g)
N2(g)+O2(g)![]() NO2(g) △H2
NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) △H3
NH3(g) △H3
则反应4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的△H为( )
A.△H1+△H2+△H3B.2△H1+2△H2-2△H3
C.6△H1+4△H2+4△H3D.6△H1+4△H2-4△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取20 mL某浓度的盐酸作为待测液,用-定物质的量浓度的NaOH溶液进行滴定(溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示。下列叙述不正确的是( )
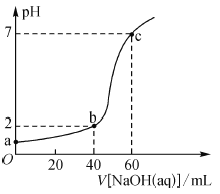
A.盐酸与NaOH溶液初始浓度关系为c(HCl)-2c(NaOH)=0.03mol·L-1
B.b点溶液中:c(Cl-)>c(Na+)>c(H+)>c(OH-)
C.a、b、c点溶液中水的电离程度大小依次为:a>b>c
D.滴定前,锥形瓶用待测液润洗,会导致所测HCl浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )

A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为50%
C. 2min内A的反应速率为0.3mol·L-1·min-1
D. 若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是![]()
A.原子半径:![]()
B.标准状况下的![]() LM溶于水,所得溶液
LM溶于水,所得溶液![]()
C.![]() 能使湿润的淀粉KI试纸变蓝
能使湿润的淀粉KI试纸变蓝
D.一定条件下,Cu可与W的最高价氧化物对应水化物发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com