
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
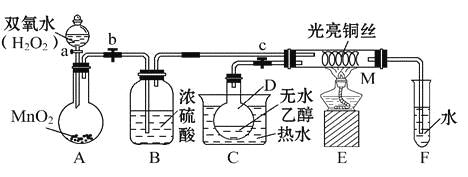
(1)A中发生反应的化学方程式:__________________,B的作用:_____________;C中热水的作用:_____________________。
(2)M处发生反应的化学方程式为_________________。
(3)从M管中可观察到的现象:_______________,从中可认识到该实验过程中催化剂______(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的_____________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应__________(填“能”或“不能”)继续进行,其原因是_____________。
(5)验证乙醇氧化产物的化学方法是______________________。
【答案】2H2O2![]() 2H2O+O2↑ 干燥O2 使D中乙醇变为蒸气进入M参加反应,用水浴加热使乙醇气流较平稳 2CH3CH2OH+O2
2H2O+O2↑ 干燥O2 使D中乙醇变为蒸气进入M参加反应,用水浴加热使乙醇气流较平稳 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 受热部分的铜丝交替出现变黑、变红的现象 参加 温度 能 乙醇的催化氧化反应是放热反应,反应放出的热量能维持反应继续进行 实验结束后,卸下装置F中盛有少量蒸馏水的试管,从中取出少许溶液做银镜反应实验[也可使之与新制Cu(OH)2悬浊液反应],来证明乙醛的生成
2CH3CHO+2H2O 受热部分的铜丝交替出现变黑、变红的现象 参加 温度 能 乙醇的催化氧化反应是放热反应,反应放出的热量能维持反应继续进行 实验结束后,卸下装置F中盛有少量蒸馏水的试管,从中取出少许溶液做银镜反应实验[也可使之与新制Cu(OH)2悬浊液反应],来证明乙醛的生成
【解析】
试题(1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑;B是吸收氧气中的水蒸气,即干燥O2;C中热水的作用是使D中乙醇变为蒸气进入M参加反应,用水浴加热使乙醇气流较平稳;
2H2O+O2↑;B是吸收氧气中的水蒸气,即干燥O2;C中热水的作用是使D中乙醇变为蒸气进入M参加反应,用水浴加热使乙醇气流较平稳;
(2)M处发生的反应是乙醇的催化氧化反应生成乙醛,反应的化学方程式为: 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ;
2CH3CHO+2H2O ;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜,受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;催化剂参加反应过程,催化作用需要一定的温度。
(4)因为乙醇的催化氧化反应是放热反应,反应放出的热量能维持反应继续进行。
(5)乙醇氧化为乙醛,依据醛基检验方法进行设计实验,也可以利用新制的氢氧化铜加热生成砖红色沉淀来判断化学反应,所以验证乙醇氧化产物的化学方法是实验结束后,卸下装置F中盛有少量蒸馏水的试管,从中取出少许溶液做银镜反应实验[也可使之与新制Cu(OH)2悬浊液反应],来证明乙醛的生成。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() 时,
时,![]() NaOH溶液和
NaOH溶液和![]()
![]() 混合,若溶液显酸性,则所得溶液中离子浓度可能为:
混合,若溶液显酸性,则所得溶液中离子浓度可能为:![]()
B.取![]() 的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入
的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入![]() 锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
C.用浓盐酸酸化的![]() 溶液与
溶液与![]() 反应,证明
反应,证明![]() 具有还原性:
具有还原性:![]()
D.含等物质的量的![]() 和
和![]() 的溶液中存在:
的溶液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和100g10%的K2SO4溶液,电极均为石墨电极.

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为______;
③电极b上生成的气体在标准状况下的体积:______;
④电极c的质量变化是______g;
⑤电解前后各溶液的pH值的变化(填“不变”、“变大”或“变小”):甲溶液______,乙溶液______,丙溶液______;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,____(填“能”或“不能”),原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图。已知:苯环上卤素不水解,下列有关说法不正确的是
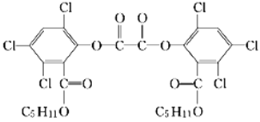
A. 草酸二酯的分子式为C26H24Cl6O8
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 1 mol草酸二酯与氢气完全反应,需要氢气6 mol
D. 1 mol草酸二酯与氢氧化钠稀溶液反应,最多消耗4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
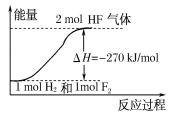
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是

A. 铁丝在两处的腐蚀速率:a < b
B. a、b两处相同的电极反应式为Fe-2e-==Fe2+
C. 一段时间后,a处液面高于b处液面
D. 生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学-物质结构与性质)
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显_____价,A的电负性________B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因__________________________________________________________________________。
共价键 | C-C | C-N | C-S |
键能/ kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是________________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),
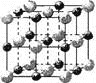
其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体(不包括aCl)熔点从高到低的顺序是:_________________。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有_______个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是_____________。
(5)某配合物的分子结构如右图所示,其分子内不含有____(填序号)。
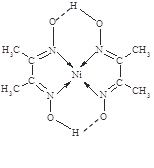
A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
(6)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
若有1mol CH4生成,则有______molσ键和______molπ键断裂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用石墨电极电解100mL、0.1molL-1NH4Cl溶液,电解过程中溶液体积变化忽略不计,溶液的pH随阳极产生气体体积(标准状况下)变化的曲线如图,下列说法正确的是( )
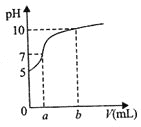
A.溶液pH=5时,c(NH3H2O)=1.0×10-5molL-1
B.电解过程使NH4+的水解程度减小,pH增大
C.若b=56mL,c(NH4+)≈5.01×10-2molL-1
D.若将阳极产生的bmL气体重新通回溶液,c(NH4+)不会改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )

A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.![]() 的体积分数:
的体积分数:![]()
D.容器I和容器II中![]() 的体积分数相同
的体积分数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com