
【题目】(1)某元素M,其离子M2+,M2+原子核核内有20个中子,核外有18个电子,则M的质子数是__________,质量数是_________
(2)根据下列叙述,写出微粒符号和结构示意图。
a.原子核外有2个电子层,核外有10个电子的原子________、______________;
b.质量数为24,质子数等于中子数的原子_________、__________________;
c.最外层电子数是次外层电子数的4倍的二价阴离子_________、_________________。
(3)结构示意图为 的阳离子,其电子式符号可能为________、________、________。
的阳离子,其电子式符号可能为________、________、________。
【答案】 20 40 Ne ![]() Mg
Mg ![]() O2-
O2- ![]() Na+ Mg2+ Al3+
Na+ Mg2+ Al3+
【解析】试题分析:(1)阳离子的核外电子数=质子数—电荷数;质量数=质子数+中子数;(2)a.核外有10个电子的原子是Ne;b. 质量数为24,而质量数=质子数+中子数,质子数=中子数,所以质子数=12,该原子是Mg;c.最外层电子数是次外层电子数的4倍的二价阴离子是O2-;(3)结构示意图为 的阳离子,可能是钠离子、镁离子、铝离子;
的阳离子,可能是钠离子、镁离子、铝离子;
解析:阳离子的核外电子数=质子数—电荷数,M2+核外有18个电子,所以M的质子数是20;质量数=质子数+中子数,M2+原子核核内有20个中子,所以质量数是40;(2)a.核外有10个电子的原子是Ne,原子结构示意图为![]() ;b. 质量数为24,而质量数=质子数+中子数,质子数=中子数,所以质子数=12,该原子是Mg,原子结构示意图为
;b. 质量数为24,而质量数=质子数+中子数,质子数=中子数,所以质子数=12,该原子是Mg,原子结构示意图为![]() ;c.最外层电子数是次外层电子数的4倍的二价阴离子是O2-,结构示意图为
;c.最外层电子数是次外层电子数的4倍的二价阴离子是O2-,结构示意图为![]() ;(3)结构示意图为
;(3)结构示意图为 的阳离子,可能是钠离子、镁离子、铝离子,电子式符号为Na+ 、 Mg2+ 、 Al3+;
的阳离子,可能是钠离子、镁离子、铝离子,电子式符号为Na+ 、 Mg2+ 、 Al3+;


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) 2C(s)+O2(g)=2CO(g)
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的化学方程式:________________
② 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是_____________________。
③ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
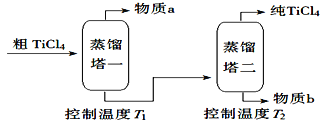
物质a是_________,T2应控制在_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下关系的化学反应。
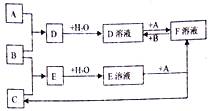
回答以下问题:
(1)写出B的化学式:____________
(2)写出E溶液和+A→F溶液+C的离子反应方程式:___________________。D溶液和+A→F溶液的离子反应方程式:_______________________________。若向F溶液中加入NaOH溶液,观察到的现象为:________________________。
(3)写出除去D溶液中F杂质的离子反应方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时, Ksp (AgCl)= 1.56×10-10, Ksp(Ag2CrO4)= 9.0×10-12,下列说法正确的是
A. AgCl 和 Ag2CrO4 共存的悬浊液中,![]()
B. 向Ag2CrO4悬浊液中加入 NaCl 浓溶液, Ag2CrO4不可能转化为 AgCl
C. 向 AgCl 饱和溶液中加入 NaCl 晶体, 有 AgC1 析出且溶液中 c(Cl-)=c(Ag+)
D. 向同浓度的 Na2CrO4和 NaCl 混合溶液中滴加 AgNO3溶液,AgC1先析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X 常温下为气体, a、b、c 是中学化学常见物质, 均由常见元素组成, 转化关系(反应条件略去)如图所示, 下列说法不正确的是
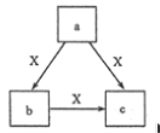
A. 若 X 为 O2, a 为一种固态单质, 则 c 可能为 CO2或 SO3
B. 若 b 为固态非金属单质, b 与 X 所含元素同主族, 则 c 也能与 X 反应
C. 若 a、 b、 c 焰色反应均呈黄色, 水溶液均呈碱性, 则 a 中可能既含有离子键又含有共价键
D. 若 b 为气态非金属单质, b 与 X 所含元素同周期, 则 X 与 b 所含元素原子的核电荷数相差 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在分子机器设计与合成领域方面的成就,其中一种光驱分子马达结构如右图所示。有关该分子的说法不正确的是

A. 光驱分子马达的分子式是C34H46O2,属于烃的含氧衍生物
B. 分子机器设计与合成的研究成果为未来新材料的研发开启了广阔前景
C. 三位科学家通过研究质子和中子重新合成了新的元素
D. 光驱分子马达能与NaHCO3和酸性KMnO4溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气 CO2 可制取甲醇。 下列两个反应的能量关系如图:
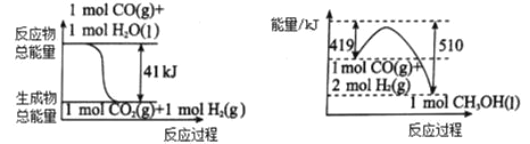
则 CO2与 H2 反应生成 CH3OH 的热化学方程式为_______________________。
(2)CH4 和 H2O(g)通过下列转化也可以制得 CH3OH;
I. CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
II. CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
将 1.0 mol CH4和 3.0 mol H2O(g)通入反应室(容积为 100 L)中,在一定条件下发生反应 I, CH4 的转化率与温度、压强的关系如下图所示:
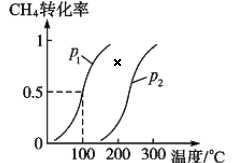
①已知压强 p1, 温度为 100 ℃时反应 I 达到平衡所需的时间为 5 min,则用 H2表示的平均反应速率为______________;
②图中的 p1_______p2(填“<”、 “>”或“=”),判断的理由是________________________。
③若反应 II 在恒容密闭容器进行,下列能判断反应 II 达到平衡状态的是_________(填字母)。
a.CH3OH 的生成速率与消耗 CO 的速率相等
b.混合气体的密度不变
c混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④ 在某温度下,将一定量的CO和 H2投入10 L 的密闭容器中发生反应 II, 5 min 时达到平衡,各物质的物质的浓度(mol·L ﹣1)变化如下表所示:
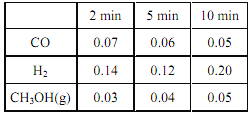
若 5 min 时只改变了某一条件,则所改变的条件是_____________; 10 min 时测得各物质浓度如上表,此时 v正_______v逆(填“<”、 “>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H=== -b kJ/mol
若a、b均大于零,则a和b的关系为
A.a<bB.a=bC.a>bD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值,下列说法正确的是
A. 2.8 g铁与0.05 mol Cl2充分反应,转移0.15NA电子
B. 27 g Al与足量NaOH溶液反应生成33.6 L H2
C. 14 g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D. 300 mL 0.2 mol/L蔗糖溶液中所含分子数为0.06NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com