
【题目】已知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下关系的化学反应。
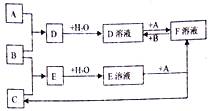
回答以下问题:
(1)写出B的化学式:____________
(2)写出E溶液和+A→F溶液+C的离子反应方程式:___________________。D溶液和+A→F溶液的离子反应方程式:_______________________________。若向F溶液中加入NaOH溶液,观察到的现象为:________________________。
(3)写出除去D溶液中F杂质的离子反应方程式:__________________________。
【答案】Cl2 Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+ 溶液中生成白色沉淀,迅速变灰绿色,最终变红褐色 2Fe2++Cl2=2Fe3++2Cl-
【解析】
A. B. C为中学化学中常见的单质,在室温下A为固体,B和C为气体,A与B反应生成D,向D溶液中加入KSCN溶液后,溶液显红色,说明D溶液中含有Fe3+,由D溶液与F溶液的相互转化关系可知,A为Fe,B为Cl2,D为FeCl3,F为FeCl2,B与C反应生成E,Fe与E溶液反应得到氯化亚铁与C,则C为H2,E为HCl。
(1).根据上述分析可知,B为Cl2,故答案为:Cl2;
(2). E为HCl,A为Fe,则E溶液和A反应的离子方程式为:Fe+2H+=Fe2++H2↑;D为FeCl3,与Fe反应的离子方程式为:2Fe3++Fe=3Fe2+;F为FeCl2,向F溶液中加入NaOH溶液,FeCl2与NaOH反应生成Fe(OH)2白色沉淀,Fe(OH)2迅速被空气中的氧气氧化生成Fe(OH)3,所以观察到的实验现象是:溶液中生成白色沉淀,迅速变灰绿色,最终变红褐色,故答案为:Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;溶液中生成白色沉淀,迅速变灰绿色,最终变红褐色;
(3). D为FeCl3,F为FeCl2,除去FeCl3溶液中FeCl2杂质,可以向溶液中通入足量的氯气,将Fe2+氧化为Fe3+,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
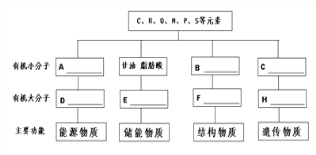
(1)A一般是指_____________;D在动物细胞中是指__________。
(2)E 是指_____________,它还有___________________的功能。
(3)B是指____________,其结构通式是______________,B形成[F]_________ 的过程叫____________。
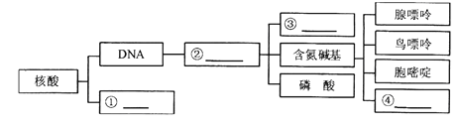
(4)如图中,是指______________,②是指______________,其中③是指___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
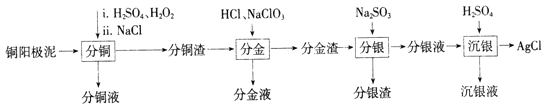
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
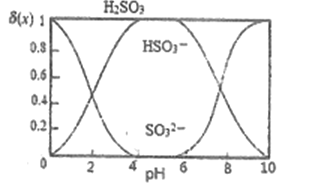
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氣(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。请回答:

Ⅰ.Cl2的制备
(1)Cl2的发生装置可以选择上图中的____________(填大写字母),反应的离子方程式为__________.
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a![]() _____(按气流方向,用小写字母表示)。
_____(按气流方向,用小写字母表示)。
Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO);
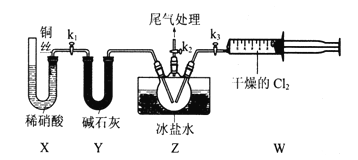
(3)实验室也可用B装置制备NO,与之相比X装置的优点为_______.
(4)在检查完装置气密性,并装入药品后,打开k2,然后再打开________(填“k1”"或“k3”),通入一段时间气体,其目的为_________。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。
Ⅲ.亚硝酰氯(ClNO)纯度的测定
取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4。溶液为指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为___________.
(6)亚硝酰氯(ClNO)的质量分数为_________(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的图示与对应的叙述相符的是

A. 图1表示向l00mL0.l mol·L-l的A1Cl3溶液中滴加1 mol·L-1的NaOH溶液时n [Al(OH)3]的变化情况
B. 图2表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
C. 图3表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变
D. 图4表示向Na2CO3溶液中滴加稀盐酸时,产生n(CO2)的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时, 下列溶液中微粒浓度关系正确的是
A. 氨水稀释 10 倍后, 其 c(OH-)等于原来的![]()
B. pH=5 的 H2C2O4 溶液中: c(H+)=c(HC2O4 -)=1×10-5mol/L
C. pH 之和为 14 的 H2S 溶液与 NaOH 溶液混合: c(Na+)+c(H+)=c(OH-)+c(HS- )
D. (NH4)2SO4和 NaOH 混合所得的中性溶液中(不考虑 NH3): c(Na+)=c(NH3 ·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2gCu与足量的浓硫酸在加热条件下充分反应。
(1)把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的![]() 溶液,得到沉淀2.33g,则稀释后所得溶液中
溶液,得到沉淀2.33g,则稀释后所得溶液中![]() 的物质的量浓度为__________。
的物质的量浓度为__________。
(2)把产生的气体缓缓通入100mL a![]() 的NaOH溶液中,若反应物均无剩余,则a的取值范围是____________。
的NaOH溶液中,若反应物均无剩余,则a的取值范围是____________。
(3)若浓硫酸中含溶质b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(![]() )_________0.5b mol(填“>”“<”或“=”);原因是_____________________________
)_________0.5b mol(填“>”“<”或“=”);原因是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素M,其离子M2+,M2+原子核核内有20个中子,核外有18个电子,则M的质子数是__________,质量数是_________
(2)根据下列叙述,写出微粒符号和结构示意图。
a.原子核外有2个电子层,核外有10个电子的原子________、______________;
b.质量数为24,质子数等于中子数的原子_________、__________________;
c.最外层电子数是次外层电子数的4倍的二价阴离子_________、_________________。
(3)结构示意图为 的阳离子,其电子式符号可能为________、________、________。
的阳离子,其电子式符号可能为________、________、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com