
����Ŀ����3.2gCu��������Ũ�����ڼ��������³�ַ�Ӧ��
��1���ѷ�Ӧ�����Һϡ����500mL��ȡ��50mL�������м���������![]() ��Һ,�õ�����2.33g����ϡ�ͺ�������Һ��
��Һ,�õ�����2.33g����ϡ�ͺ�������Һ��![]() �����ʵ���Ũ��Ϊ__________��
�����ʵ���Ũ��Ϊ__________��
��2���Ѳ��������建��ͨ��100mL a![]() ��NaOH��Һ�У�����Ӧ�����ʣ�࣬��a��ȡֵ��Χ��____________��
��NaOH��Һ�У�����Ӧ�����ʣ�࣬��a��ȡֵ��Χ��____________��
��3����Ũ�����к�����b mol��Ͷ��������ͭƬ�����ȣ���ַ�Ӧ����ԭ����������ʵ���n(![]() )_________0.5b mol(����>����<������=��)��ԭ����_____________________________
)_________0.5b mol(����>����<������=��)��ԭ����_____________________________
���𰸡�0.2 mol/L 0.5 ��a �� 1 �� �淴Ӧ���У�����Ũ�ȱ�С��ϡ�����ͭ��Ӧ
��������
���⿼��ͭ��Ũ���ᷴӦ����1����������BaCl2��Һ���г�������������Ba2����SO42��=BaSO4����BaSO4������Ϊ2.33g������SO42�������ʵ���Ϊ2.33/233mol=0.01mol����c(SO42��)=0.01/50��10��3mol��L��1=0.2mol��L��1����500mL����Һc(SO42��)=0.2mol��L��1����2��ͭ��������Ũ���ᷴӦ��Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O������SO2�����ʵ���Ϊ3.2/64mol=0.05mol��SO2��NaOH��Ӧ����Ӧ�����ʣ�࣬����������Na2SO3��NaHSO3��Na2SO3��NaHSO3�Ļ�������ȫ�����ɵ���Na2SO3������100��10��3��a=2��0.05����a=1������ȫ��ΪNaHSO3������100��10��3��a=0.05����a=0.5���ó�a�ķ�Χ��0.5 ��a �� 1����3��ͭ��Ũ���ᷢ����Cu��2H2SO4(Ũ)
CuSO4��SO2����2H2O������SO2�����ʵ���Ϊ3.2/64mol=0.05mol��SO2��NaOH��Ӧ����Ӧ�����ʣ�࣬����������Na2SO3��NaHSO3��Na2SO3��NaHSO3�Ļ�������ȫ�����ɵ���Na2SO3������100��10��3��a=2��0.05����a=1������ȫ��ΪNaHSO3������100��10��3��a=0.05����a=0.5���ó�a�ķ�Χ��0.5 ��a �� 1����3��ͭ��Ũ���ᷢ����Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O��������ȫ���μӷ�Ӧ������ԭ����������ʵ���Ϊ0.5b��ֻͭ��Ũ���ᷢ����Ӧ������ϡ���ᷢ����Ӧ�����ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ�ת��Ϊϡ����ʱ����Ӧ��ֹͣ����˱���ԭ����������ʵ���<0.5b��
CuSO4��SO2����2H2O��������ȫ���μӷ�Ӧ������ԭ����������ʵ���Ϊ0.5b��ֻͭ��Ũ���ᷢ����Ӧ������ϡ���ᷢ����Ӧ�����ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ�ת��Ϊϡ����ʱ����Ӧ��ֹͣ����˱���ԭ����������ʵ���<0.5b��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��������и�С��
��1��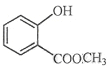 �к��еĹ����ŵ�����Ϊ__________________________��
�к��еĹ����ŵ�����Ϊ__________________________��
��2��1��4-���ױ��Ľṹ��ʽ________________________________________��
��3�����CH3CH(C2H5)CH(CH3)2��������________________________��
��4��![]() �ķ���ʽ________________��������____________________��
�ķ���ʽ________________��������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���SO2���ʵ�˵���У�����ȷ���ǣ� ��
A.��ʹ����KMnO4��Һ��ɫ
B.��ʹƷ����Һ��ɫ
C.����NaOH��Һ��Ӧ
D.����ˮ��Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʣ���������AΪ���壬B��CΪ���壬��D��Һ�м���KSCN��Һ����Һ�Ժ�ɫ�������˵������¿ɷ������¹�ϵ�Ļ�ѧ��Ӧ��
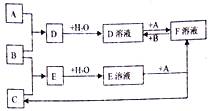
�ش��������⣺
��1��д��B�Ļ�ѧʽ��____________
��2��д��E��Һ��+A��F��Һ+C�����ӷ�Ӧ����ʽ��___________________��D��Һ��+A��F��Һ�����ӷ�Ӧ����ʽ��_______________________________������F��Һ�м���NaOH��Һ���۲쵽������Ϊ��________________________��
��3��д����ȥD��Һ��F���ʵ����ӷ�Ӧ����ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����(����)
A. �����ۡ��е�ĸߵ�˳���Ǿ����>�Ȼ���>��>����
B. ���뾶�ɴ�С��˳����H��>Li��>H��
C. ���ʯ��Ӳ�ȡ��۵㡢�е㶼���ھ����
D. CO2��HCl��CF4��PCl3�������ʷ����е�����ԭ�Ӷ����������Ϊ8���ӵ��ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��Cʱ�� Ksp (AgCl)= 1.56��10-10�� Ksp(Ag2CrO4)= 9.0��10-12,����˵����ȷ����
A. AgCl �� Ag2CrO4 ���������Һ����![]()
B. ��Ag2CrO4����Һ�м��� NaCl Ũ��Һ�� Ag2CrO4������ת��Ϊ AgCl
C. �� AgCl ������Һ�м��� NaCl ������ �� AgC1 ��������Һ�� c(Cl��)=c(Ag��)
D. ��ͬŨ�ȵ� Na2CrO4�� NaCl �����Һ�еμ� AgNO3��Һ��AgC1������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X ������Ϊ���壬 a��b��c ����ѧ��ѧ�������ʣ� ���ɳ���Ԫ����ɣ� ת����ϵ(��Ӧ������ȥ)��ͼ��ʾ�� ����˵������ȷ����
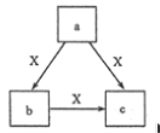
A. �� X Ϊ O2�� a Ϊһ�ֹ�̬���ʣ� �� c ����Ϊ CO2�� SO3
B. �� b Ϊ��̬�ǽ������ʣ� b �� X ����Ԫ��ͬ���壬 �� c Ҳ���� X ��Ӧ
C. �� a�� b�� c ��ɫ��Ӧ���ʻ�ɫ�� ˮ��Һ���ʼ��ԣ� �� a �п��ܼȺ������Ӽ��ֺ��й��ۼ�
D. �� b Ϊ��̬�ǽ������ʣ� b �� X ����Ԫ��ͬ���ڣ� �� X �� b ����Ԫ��ԭ�ӵĺ˵������� 1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ����������������ٵ��ش���⣬�״���δ����Ҫ����ɫ��Դ֮һ��
��1�����ù�ҵ���� CO2 ����ȡ�״��� ����������Ӧ��������ϵ��ͼ��
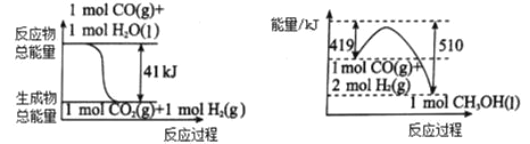
�� CO2�� H2 ��Ӧ���� CH3OH ���Ȼ�ѧ����ʽΪ_______________________��
��2��CH4 �� H2O(g)ͨ������ת��Ҳ�����Ƶ� CH3OH��
I�� CH4(g)+H2O(g)![]() CO(g)+3H2(g) ����H>0
CO(g)+3H2(g) ����H>0
II�� CO(g)+2H2(g) ![]() CH3OH(g) ������H<0
CH3OH(g) ������H<0
�� 1.0 mol CH4�� 3.0 mol H2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊ 100 L)�У���һ�������·�����Ӧ I�� CH4 ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
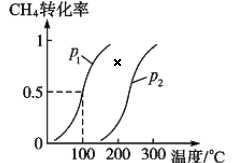
����֪ѹǿ p1�� �¶�Ϊ 100 ��ʱ��Ӧ I �ﵽƽ�������ʱ��Ϊ 5 min������ H2��ʾ��ƽ����Ӧ����Ϊ______________��
��ͼ�е� p1_______p2(����<���� ��>������=��)���жϵ�������________________________��
������Ӧ II �ں����ܱ��������У��������жϷ�Ӧ II �ﵽƽ��״̬����_________(����ĸ)��
a.CH3OH ���������������� CO ���������
b.���������ܶȲ���
c�������������ʵ�������
d��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
�� ��ij�¶��£���һ������CO�� H2Ͷ��10 L ���ܱ������з�����Ӧ II�� 5 min ʱ�ﵽƽ�⣬�����ʵ����ʵ�Ũ��(mol��L ��1)�仯���±���ʾ��
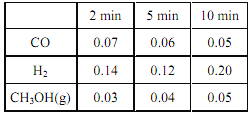
�� 5 min ʱֻ�ı���ijһ�����������ı��������_____________�� 10 min ʱ��ø�����Ũ�����ϱ�����ʱ v��_______v��(����<���� ��>������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ҪӪ������֮һ������ʳ���У����������ʵ���
A. ��ͷ B. ���� C. ������ D. ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com