
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气 CO2 可制取甲醇。 下列两个反应的能量关系如图:
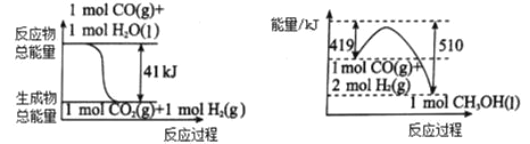
则 CO2与 H2 反应生成 CH3OH 的热化学方程式为_______________________。
(2)CH4 和 H2O(g)通过下列转化也可以制得 CH3OH;
I. CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
II. CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
将 1.0 mol CH4和 3.0 mol H2O(g)通入反应室(容积为 100 L)中,在一定条件下发生反应 I, CH4 的转化率与温度、压强的关系如下图所示:
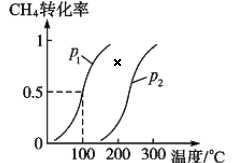
①已知压强 p1, 温度为 100 ℃时反应 I 达到平衡所需的时间为 5 min,则用 H2表示的平均反应速率为______________;
②图中的 p1_______p2(填“<”、 “>”或“=”),判断的理由是________________________。
③若反应 II 在恒容密闭容器进行,下列能判断反应 II 达到平衡状态的是_________(填字母)。
a.CH3OH 的生成速率与消耗 CO 的速率相等
b.混合气体的密度不变
c混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④ 在某温度下,将一定量的CO和 H2投入10 L 的密闭容器中发生反应 II, 5 min 时达到平衡,各物质的物质的浓度(mol·L ﹣1)变化如下表所示:
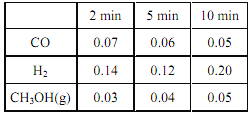
若 5 min 时只改变了某一条件,则所改变的条件是_____________; 10 min 时测得各物质浓度如上表,此时 v正_______v逆(填“<”、 “>”或“=”)。
【答案】 CO2(g)+3H2(g)=CH3OH(l)+H2O(l) △H=-50kJ/mol 0.003mol/(L·min) < 该反应为反应前后气体分子数增大的反应,温度相同时,增大压强,平衡向左移动,CH4的平衡转化率越小 cd 向容器中充入1molH2 >
【解析】(1)根据能量变化图象,可写出反应的热化学方程式为①CO(g)+H2O(l)===CO2(g)+H2(g) △H1= -41KJ/mol,②CO(g)+2H2(g) === CH3OH(l) △H2=419KJ/mol-510KJ/mol= -91KJ/mol,由盖斯定律②-①即得CO2(g)+3H2(g) === CH3OH(l)+H2O(l) △H=△H2-△H1= -50KJ/mol;
(2)①由图象可知在压强p1,温度为100 ℃时,反应I 达到平衡CH4 的转化率为50%,则生成H2的物质的量为1.0 mol×50%×3=1.5mol,则用H2表示的平均反应速率为=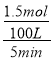 =0.003 mol/(L·min);
=0.003 mol/(L·min);
②在同一温度下,p1时CH4的平衡转化率大于p2时的,结合反应I是一个气体体积增大的反应,所以减小压强,可使平衡正向移动,增大CH4的平衡转化率,因此可推知p1<p2;
③a、在反应开始进行后的任何时间段内,CH3OH的生成速率与消耗CO的速率都是相等的,所以a错误;b、由于容器体积不变,所以容器内混合气体的密度始终不变,故b错误;c、由于反应前后气体总物质的量减小,所以当混合气体的总物质的量不变时,说明反应已达平衡,故c正确;d、CH3OH、CO、H2的浓度都不再发生变化,说明反应已达平衡,故d正确。本题正确答案为cd。
④已知表中数据,从5 min到10 min,CO的浓度减小了0.01mol/L,CH3OH的浓度增大了0.01mol/L,说明平衡正向移动,按照反应系数之间的关系,反应物H2的浓度应减小0.02mol/L,即为0.10mol/L,可实际上H2的浓度为0.20mol/L,即增大了0.1mol/L,说明5 min时改变的条件是向容器中充入了1mol的H2;由于增大了反应物的浓度,使平衡正向移动,则v正>v逆。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
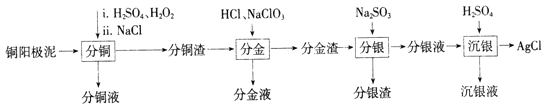
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
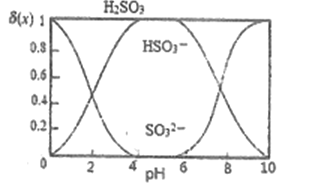
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2gCu与足量的浓硫酸在加热条件下充分反应。
(1)把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的![]() 溶液,得到沉淀2.33g,则稀释后所得溶液中
溶液,得到沉淀2.33g,则稀释后所得溶液中![]() 的物质的量浓度为__________。
的物质的量浓度为__________。
(2)把产生的气体缓缓通入100mL a![]() 的NaOH溶液中,若反应物均无剩余,则a的取值范围是____________。
的NaOH溶液中,若反应物均无剩余,则a的取值范围是____________。
(3)若浓硫酸中含溶质b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(![]() )_________0.5b mol(填“>”“<”或“=”);原因是_____________________________
)_________0.5b mol(填“>”“<”或“=”);原因是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素M,其离子M2+,M2+原子核核内有20个中子,核外有18个电子,则M的质子数是__________,质量数是_________
(2)根据下列叙述,写出微粒符号和结构示意图。
a.原子核外有2个电子层,核外有10个电子的原子________、______________;
b.质量数为24,质子数等于中子数的原子_________、__________________;
c.最外层电子数是次外层电子数的4倍的二价阴离子_________、_________________。
(3)结构示意图为 的阳离子,其电子式符号可能为________、________、________。
的阳离子,其电子式符号可能为________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 向CH3CH2Br中滴入AgNO3溶液以检验溴元素
B. 乙醇能使酸性高锰酸钾溶液褪色
C. 向无水乙醇中加入浓H2SO4,加热至170 ℃,产生的使酸性KMnO4溶液褪色的气体只是乙烯
D. ![]() 遇FeCl3溶液可显紫色
遇FeCl3溶液可显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中说明某化学平衡一定发生移动的是 ( )
A.反应物的转化率改变B.正、逆反应速率改变
C.混合物中各组分的浓度改变D.混合体系中气体密度发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:

已知以下信息:
①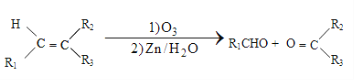
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为______________,反应类型为________。
(2)D的化学名称是________,由D生成E的化学方程式为:_______________。
(3)G的结构简式为__________________。
(4)F的同分异构体中含有苯环的有多种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是____________。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
![]()
反应条件1所选择的试剂为_______;反应条件2所选择的试剂为________;I的结构简式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com