
����Ŀ��ͭ����������ɫ����ұ����������Ҫ����������Դ�����������������ʵ����Դ���ۺ����þ�����Ҫ���塣һ�ִ�ͭ�������з�����ȡ���ֽ���Ԫ�صĹ�����������:
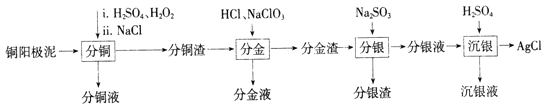
��֪:�ֽ�Һ����Ҫ�ɷ�Ϊ[AuCl4]-;�ֽ�������Ҫ�ɷ�ΪAgCl��PbSO4;����Һ����Ҫ�ɷ�Ϊ[Ag(SO3)2]3-���Ҵ���[Ag(SO3)2]3-![]() Ag++2SO32-��
Ag++2SO32-��
��1��������ͭ��ʱ,����ͭ������Ӧ�Ļ�ѧ����ʽΪ________����Ӧ������������ʵ��¶ȣ��¶Ȳ��˹�����͵�ԭ��Ϊ_______��
����֪����ͭ��ʱ ��Ԫ�صĽ��������±���ʾ��
Cu | Au | Ag | |
������/% | 85.7 | 0 | 4.5 |
����ͭ��ʱ����������NaCl����Ҫ����Ϊ__________
��2�����ֽ���ʱ,���ʽ�����Ӧ�����ӷ���ʽΪ___________��
��3����������ʱ����������������Һ��pH=4����֪: ![]() ,����X��ʾSO32-��HSO3-��H2SO3,��(x)��PH�Ĺ�ϵ��ͼ��ʾ��
,����X��ʾSO32-��HSO3-��H2SO3,��(x)��PH�Ĺ�ϵ��ͼ��ʾ��
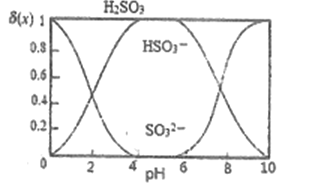
�ٷ����ܹ�����AgCl��ԭ��Ϊ_________
�ڵ�����Һ��PH���ܹ��ͣ�����Ϊ__________
��4��������Һ���Ӽ����pH=8.0,Na2SO3��������ѭ�����ã�������ԭ��Ϊ____(�����ӷ���ʽ��ʾ)��
��5����֪����Ũ����10-5mol/Lʱ����Ϊ�����ӳ�����ȫ��Ksp[Pb(OH)2]=2.5��10-16.
Ksp[Sb(OH)3])=10-41. ��ȡ�����������ɵõ���0.025mol/L Pb2+����Һ( ������Sb3+����)������ýϴ�����Pb2+��Һ������PH�ķ�ΧΪ________�� (������Һ����仯)
���𰸡� Cu+H2O2+H2SO4=CuSO4+2H2O �¶ȹ�������Ӧ����̫��;�¶ȹ�����H2O2���ȷֽ� ʹ�ܽ����Ag+�γ�AgCl�����ͭ����������Ԫ�ص���ʧ 2Au+ClO3-+7Cl-+6H+=2[AuCl4]- H2SO4�������H+������SO32-��Ũ������ʹ[Ag(SO3)2]3![]() Ag++2SO32-ƽ�������ƶ��������Ag+��Ag+�����Һ�е�Cl-��Ӧ����AgCl ���������Ⱦ����SO2 HSO3-+OH-=SO32-+H2O 2��pH<7
Ag++2SO32-ƽ�������ƶ��������Ag+��Ag+�����Һ�е�Cl-��Ӧ����AgCl ���������Ⱦ����SO2 HSO3-+OH-=SO32-+H2O 2��pH<7
����������1��������ͭ��ʱ,����ͭ�ڹ������������������·�Ӧ��������ͭ��ˮ��������Ӧ�Ļ�ѧ����ʽΪCu��H2O2��H2SO4��CuSO4��2H2O����Ӧ������������ʵ��¶ȣ��¶Ȳ��˹�����ͣ��¶ȹ��ͣ���Ӧ����̫�����¶ȹ��ߣ�H2O2���ȷֽ⣻������ͭ��ʱ����������NaCl��ʹ�ܽ����Ag���γ�AgCl�����ͭ����������Ԫ�ص���ʧ����2�����ֽ���ʱ,���ʽ��������ƺ�������ת��Ϊ����������Ӧ�����ӷ���ʽΪ2Au��ClO![]() ��7Cl����6H����2[AuCl4]����3H2O����3����H2SO4�������H��������SO32����Ũ�ȣ���ʹ[Ag(SO3)2]3��
��7Cl����6H����2[AuCl4]����3H2O����3����H2SO4�������H��������SO32����Ũ�ȣ���ʹ[Ag(SO3)2]3��![]() Ag����2SO32��ƽ�������ƶ��������Ag����Ag�������Һ�е�Cl����Ӧ����AgCl���ڵ�����Һ��pH ���ܹ��ͣ����������Ⱦ����SO2����4��������Һ���Ӽ����pH=8.0,Na2SO3��������ѭ������,������ԭ��ΪHSO
Ag����2SO32��ƽ�������ƶ��������Ag����Ag�������Һ�е�Cl����Ӧ����AgCl���ڵ�����Һ��pH ���ܹ��ͣ����������Ⱦ����SO2����4��������Һ���Ӽ����pH=8.0,Na2SO3��������ѭ������,������ԭ��ΪHSO![]() ��OH����SO32����H2O����5������ýϴ�����Pb2+��Һ����Pb2+��Ũ��Ϊ0.025mol/L��Ksp[Pb(OH)2]=c(Pb2+)c2(OH��)= 0.025mol/L
��OH����SO32����H2O����5������ýϴ�����Pb2+��Һ����Pb2+��Ũ��Ϊ0.025mol/L��Ksp[Pb(OH)2]=c(Pb2+)c2(OH��)= 0.025mol/L ![]() c2(OH��) =2.5��10-16����c(OH��) =1.0��10-7��pH<7��Sb3+������ȫ��Ksp[Sb(OH)3]= c(Sb3+)c3(OH��)= 10-5mol/L
c2(OH��) =2.5��10-16����c(OH��) =1.0��10-7��pH<7��Sb3+������ȫ��Ksp[Sb(OH)3]= c(Sb3+)c3(OH��)= 10-5mol/L ![]() c3(OH��)=10-41��c(OH��) =1.0��10-12��pH>2����ˣ�����ýϴ�����Pb2+��Һ,����PH�ķ�ΧΪ2<pH<7��
c3(OH��)=10-41��c(OH��) =1.0��10-12��pH>2����ˣ�����ýϴ�����Pb2+��Һ,����PH�ķ�ΧΪ2<pH<7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����κ����ʳƷ��ҽҩ�ȷ������Ź㷺��;��һ�ֺϳɰ�κ��ķ�Ӧ�ɱ�ʾΪ��
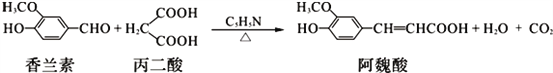
������˵������ȷ���ǣ� ��
A. ���������Ҷ��ᣨHOOC��COOH����Ϊͬϵ��
B. ��������Ϣ��֪��κ��ķ���ʽΪC10H12O4
C. �����ء���κ�ᶼ�Ƿ����廯����
D. ��κ����������10��̼ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��������и�С��
��1��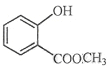 �к��еĹ����ŵ�����Ϊ__________________________��
�к��еĹ����ŵ�����Ϊ__________________________��
��2��1��4-���ױ��Ľṹ��ʽ________________________________________��
��3�����CH3CH(C2H5)CH(CH3)2��������________________________��
��4��![]() �ķ���ʽ________________��������____________________��
�ķ���ʽ________________��������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiCl4�����Ѿ�����Ҫ�ɷ�ΪTiO2���Ʊ��ѣ�Ti������Ҫ�м����Ʊ���TiCl4������ʾ��ͼ���£�

���ϣ�TiCl4�����������Ȼ��������
������ | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
�е�/�� | 58 | 136 | 181�������� | 316 | 1412 |
�۵�/�� | 69 | 25 | 193 | 304 | 714 |
��TiCl4�е��ܽ��� | ���� | ���� | �� | ���� | |
��1���Ȼ����̣�TiO2��Cl2����ֱ�ӷ�Ӧ����̼����CO��CO2��ʹ��Ӧ���Խ��С�
��֪��TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) 2C(s)+O2(g)=2CO(g)
�� ����¯�м�̼�Ȼ�����TiCl4(g)��CO(g)�Ļ�ѧ����ʽ��________________
�� �Ȼ���Ӧ��β���봦�����ŷţ�β���е�HCl��Cl2�����տɵô����ᡢFeCl3��Һ����β��������Һ������_____________________��
�� �Ȼ�������ȴ�����£������˵õ���TiCl4���Һ���������к���_____________
��2�����ƹ��̣���TiCl4����������ô�TiCl4��ʾ��ͼ���£�
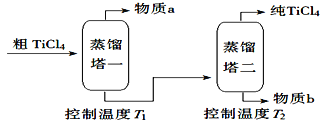
����a��_________��T2Ӧ������_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E����5��Ԫ�أ�����գ�
��1��AԪ�ػ�̬ԭ�ӵ��������3��δ�ɶԵ��ӣ��������2�����ӣ���Ԫ�ط���Ϊ_______��
��2��BԪ�صĸ�һ�����ӵĵ��Ӳ�ṹ�������ͬ��B��ԭ�ӽṹʾ��ͼΪ____��
��3��CԪ���ǵ�����������δ�ɶԵ��ӵ�����Ԫ�أ����Ĺ���Ų�ʽΪ___________��
��4��DԪ�ص����������ӵ�3d�ܼ�Ϊ����������̬ԭ�ӵĵ����Ų�ʽΪ______ ��
��5��Eԭ�ӹ���3���۵��ӣ�����һ���۵���λ�ڵ����ܲ�d�����ָ����Ԫ��������
������������������������:____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��ʽ��ϩ����)�������Ʊ�������֬��ҽҩ�ȡ�ʵ������ʯ�͵��ѽ����֮һAΪԭ���Ʊ������ἰ���������һ�ֹ���·������:
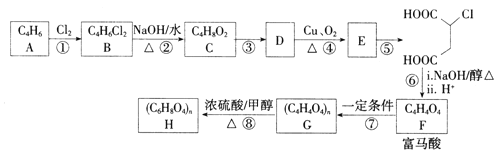
��֪:����A�ĺ˴Ź�����������2�����շ塣
��1��A�Ļ�ѧ����Ϊ________��B�Ľṹ��ʽΪ__________��
��2���۵ķ�Ӧ����Ϊ________.����E�к������������õ��Լ�Ϊ___________��
��3����Ӧ�ܵĻ�ѧ����ʽΪ___________��
��4����Ӧ��Ļ�ѧ����ʽΪ______________��
��5���������ͬ���칹����,ͬΪ��Ԫ����Ļ���__________(����˳���칹)��
��6����֪: 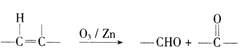 �����������ϳ�·��,��
�����������ϳ�·��,��![]() Ϊԭ��( ���Լ���ѡ).����Ʊ�
Ϊԭ��( ���Լ���ѡ).����Ʊ�![]() �ĺϳ�·��:_____________________��
�ĺϳ�·��:_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���SO2���ʵ�˵���У�����ȷ���ǣ� ��
A.��ʹ����KMnO4��Һ��ɫ
B.��ʹƷ����Һ��ɫ
C.����NaOH��Һ��Ӧ
D.����ˮ��Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʣ���������AΪ���壬B��CΪ���壬��D��Һ�м���KSCN��Һ����Һ�Ժ�ɫ�������˵������¿ɷ������¹�ϵ�Ļ�ѧ��Ӧ��
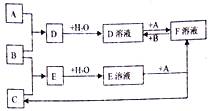
�ش��������⣺
��1��д��B�Ļ�ѧʽ��____________
��2��д��E��Һ��+A��F��Һ+C�����ӷ�Ӧ����ʽ��___________________��D��Һ��+A��F��Һ�����ӷ�Ӧ����ʽ��_______________________________������F��Һ�м���NaOH��Һ���۲쵽������Ϊ��________________________��
��3��д����ȥD��Һ��F���ʵ����ӷ�Ӧ����ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ����������������ٵ��ش���⣬�״���δ����Ҫ����ɫ��Դ֮һ��
��1�����ù�ҵ���� CO2 ����ȡ�״��� ����������Ӧ��������ϵ��ͼ��
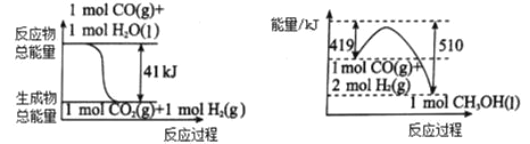
�� CO2�� H2 ��Ӧ���� CH3OH ���Ȼ�ѧ����ʽΪ_______________________��
��2��CH4 �� H2O(g)ͨ������ת��Ҳ�����Ƶ� CH3OH��
I�� CH4(g)+H2O(g)![]() CO(g)+3H2(g) ����H>0
CO(g)+3H2(g) ����H>0
II�� CO(g)+2H2(g) ![]() CH3OH(g) ������H<0
CH3OH(g) ������H<0
�� 1.0 mol CH4�� 3.0 mol H2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊ 100 L)�У���һ�������·�����Ӧ I�� CH4 ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
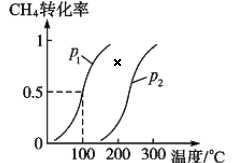
����֪ѹǿ p1�� �¶�Ϊ 100 ��ʱ��Ӧ I �ﵽƽ�������ʱ��Ϊ 5 min������ H2��ʾ��ƽ����Ӧ����Ϊ______________��
��ͼ�е� p1_______p2(����<���� ��>������=��)���жϵ�������________________________��
������Ӧ II �ں����ܱ��������У��������жϷ�Ӧ II �ﵽƽ��״̬����_________(����ĸ)��
a.CH3OH ���������������� CO ���������
b.���������ܶȲ���
c�������������ʵ�������
d��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
�� ��ij�¶��£���һ������CO�� H2Ͷ��10 L ���ܱ������з�����Ӧ II�� 5 min ʱ�ﵽƽ�⣬�����ʵ����ʵ�Ũ��(mol��L ��1)�仯���±���ʾ��
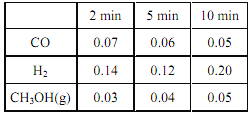
�� 5 min ʱֻ�ı���ijһ�����������ı��������_____________�� 10 min ʱ��ø�����Ũ�����ϱ�����ʱ v��_______v��(����<���� ��>������=��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com