
【题目】富马酸(反式丁烯二酸)可用于制备聚酯树脂、医药等。实验室以石油的裂解产物之一A为原料制备富马酸及其衍生物的一种工艺路线如下:
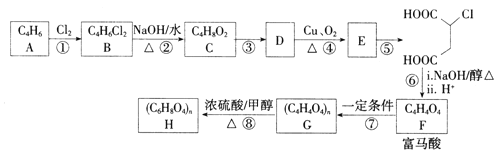
已知:链烃A的核磁共振氢谱中有2组吸收峰。
(1)A的化学名称为________,B的结构简式为__________。
(2)③的反应类型为________.检验E中含氧官能团所用的试剂为___________。
(3)反应④的化学方程式为___________。
(4)反应⑧的化学方程式为______________。
(5)富马酸的同分异构体中,同为二元羧酸的还有__________(包括顺反异构)。
(6)已知: 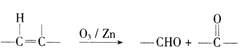 ,参照上述合成路线,以
,参照上述合成路线,以![]() 为原料( 无机试剂任选).设计制备
为原料( 无机试剂任选).设计制备![]() 的合成路线:_____________________。
的合成路线:_____________________。
【答案】 1,3-丁二烯 ![]() 加成反应 银氨溶液或新制Cu(OH)2溶液
加成反应 银氨溶液或新制Cu(OH)2溶液 
![]()
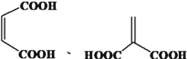
 或
或
【解析】链烃A的核磁共振氢谱中有2组吸收峰,分子式为C4H6,故高度对称,应该含有两个碳碳双键,为CH2=CHCH=CH2,CH2=CHCH=CH2与氯气发生加成反应,生成分子式为C4H6Cl2的B,结构后面物质的结构可知发生的是1,4-加成,生成B为ClCH2CH=CHCH2Cl;ClCH2CH=CHCH2Cl在氢氧化钠的水溶液中加热发生水解反应生成C为HOCH2CH=CHCH2OH;为避免碳碳双键被氧化,必须先保护后再将醇羟基氧化为醛基,则HOCH2CH=CHCH2OH与氯化氢发生加成反应生成D为HOCH2CH2CHClCH2OH,HOCH2CH2CHClCH2OH催化氧化得到E为OHCCH2CHClCHO;OHCCH2CHClCHO氧化得到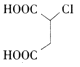 ,
, 在氢氧化钠的醇溶液中发生消去反应后酸化得到富马酸,富马酸发生加聚反应生成G为
在氢氧化钠的醇溶液中发生消去反应后酸化得到富马酸,富马酸发生加聚反应生成G为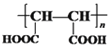 ;
;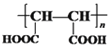 与甲醇在浓硫酸催化下发生酯化反应生成H为
与甲醇在浓硫酸催化下发生酯化反应生成H为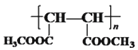 。(1)A为CH2=CHCH=CH2,化学名称为1,3-丁二烯,B的结构简式为ClCH2CH=CHCH2Cl;(2)③是HOCH2CH=CHCH2OH与氯化氢发生加成反应生成HOCH2CH2CHClCH2OH,反应类型为加成反应;检验E(OHCCH2CHClCHO)中含氧官能团醛基所用的试剂为银氨溶液或新制Cu(OH)2溶液;(3)反应④是HOCH2CH2CHClCH2OH在铜的催化下与氧气反应生成OHCCH2CHClCHO,反应的化学方程式为
。(1)A为CH2=CHCH=CH2,化学名称为1,3-丁二烯,B的结构简式为ClCH2CH=CHCH2Cl;(2)③是HOCH2CH=CHCH2OH与氯化氢发生加成反应生成HOCH2CH2CHClCH2OH,反应类型为加成反应;检验E(OHCCH2CHClCHO)中含氧官能团醛基所用的试剂为银氨溶液或新制Cu(OH)2溶液;(3)反应④是HOCH2CH2CHClCH2OH在铜的催化下与氧气反应生成OHCCH2CHClCHO,反应的化学方程式为 ;(4)反应⑧是
;(4)反应⑧是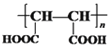 与甲醇在浓硫酸催化下发生酯化反应生成
与甲醇在浓硫酸催化下发生酯化反应生成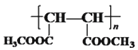 ,反应的化学方程式为
,反应的化学方程式为![]() ;(5)富马酸的同分异构体中,同为二元羧酸的还有
;(5)富马酸的同分异构体中,同为二元羧酸的还有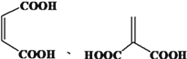 ;(6)已知:
;(6)已知: 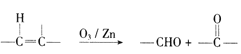 ,参照上述合成路线,
,参照上述合成路线,![]() 发生臭氧氧化得到
发生臭氧氧化得到![]() ,
,![]()
![]() ,
,![]() 在氢氧化钠的醇溶液中发生消去反应后再酸化得到
在氢氧化钠的醇溶液中发生消去反应后再酸化得到![]() ,合成路线为
,合成路线为 或
或 。
。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列离子组在室温下可能大量共存的是( )
A. pH=2的溶液:HCO3-、Na+、ClO-、NO3-
B. 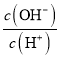 =106的溶液:Al3+、NH4+、Cl-、S2-
=106的溶液:Al3+、NH4+、Cl-、S2-
C. 水电离出的c(H+)=10-4 mol/L的溶液:Na+、K+、SO42-、CO32-
D. 使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
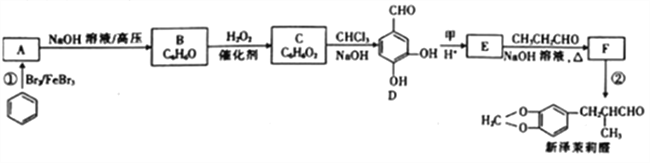
已知:①RCHO+R'CH2CHO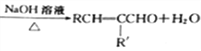
②
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备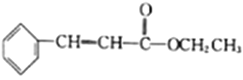 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
Ⅰ.C(g)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ/mol
2CO(g) ΔH=+172.5kJ/mol
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
请回答:
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_____________,一定温度下,该反应在密闭容器中达到平衡后,只增大容器的容积,再次达到平衡时,CO的平衡浓度_________(填“增大”、“减小”或“不变”)。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ.5min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0-5min内,用CO2表示的反应速率v(CO2)=___________.
②CO的平衡转化率a=____________.
(3)向5L密闭容器中加入1molC和1molCO2,发生反应Ⅰ。 CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示。
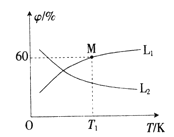
①能表示CO2的平衡体积分数与温度关系的曲线为___________(填"L1”或“L2”),理由为________。
②温度为T1时,该反应的平衡常数K=_____________。
(4)其他条件不变时,若水的分解反应用Cu2O作催化剂,则该反应的活化能_____(填“增大”、“减小”或“不变”,下同), 反应热(ΔH)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
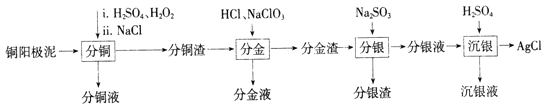
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
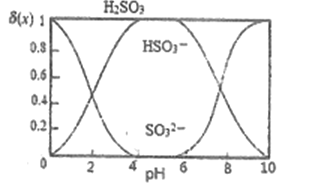
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述中正确的是
A.苯的结构中存在碳碳单键和碳碳双键
B.将苯加到溴水中,振荡、静置,上层几乎无色,下层为橙红色
C.苯分子中6个碳碳键完全相同
D.苯在催化剂作用下可以与液溴发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氣(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。请回答:

Ⅰ.Cl2的制备
(1)Cl2的发生装置可以选择上图中的____________(填大写字母),反应的离子方程式为__________.
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a![]() _____(按气流方向,用小写字母表示)。
_____(按气流方向,用小写字母表示)。
Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO);
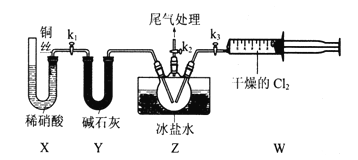
(3)实验室也可用B装置制备NO,与之相比X装置的优点为_______.
(4)在检查完装置气密性,并装入药品后,打开k2,然后再打开________(填“k1”"或“k3”),通入一段时间气体,其目的为_________。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。
Ⅲ.亚硝酰氯(ClNO)纯度的测定
取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4。溶液为指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为___________.
(6)亚硝酰氯(ClNO)的质量分数为_________(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时, 下列溶液中微粒浓度关系正确的是
A. 氨水稀释 10 倍后, 其 c(OH-)等于原来的![]()
B. pH=5 的 H2C2O4 溶液中: c(H+)=c(HC2O4 -)=1×10-5mol/L
C. pH 之和为 14 的 H2S 溶液与 NaOH 溶液混合: c(Na+)+c(H+)=c(OH-)+c(HS- )
D. (NH4)2SO4和 NaOH 混合所得的中性溶液中(不考虑 NH3): c(Na+)=c(NH3 ·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中说明某化学平衡一定发生移动的是 ( )
A.反应物的转化率改变B.正、逆反应速率改变
C.混合物中各组分的浓度改变D.混合体系中气体密度发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com