
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为:
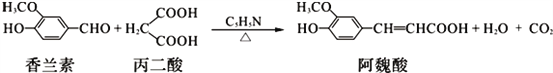
则下列说法不正确的是( )
A. 丙二酸与乙二酸(HOOC—COOH)互为同系物
B. 由题中信息可知阿魏酸的分子式为C10H12O4
C. 香兰素、阿魏酸都是芳香族化合物
D. 阿魏酸分子最多有10个碳原子共平面
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
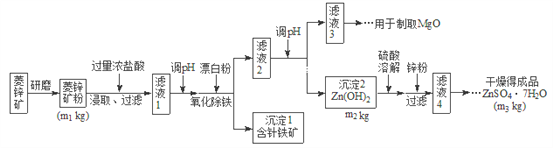
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的下列叙述中,不正确的是( )
A.实验室制氨气的方法是加热NH4Cl
B.液氨是纯净物
C.氨易液化,因此可用来作制冷剂
D.氨极易溶于水,因此可用来作喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A在无催化条件和有酶催化条件下生成物质P所需的能量变化如图,下列相关叙述正确的是( )
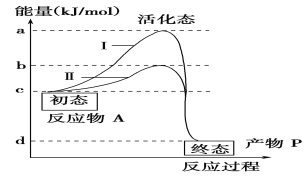
A. 若Ⅱ表示酶促反应曲线,则加热加压曲线应该在Ⅰ、Ⅱ之间
B. bd段表示在有酶催化剂条件下,物质A生成物质P化学反应顺利进行所提供的活化能
C. 若增加酶的量,则图中曲线的原有形状不发生改变
D. 曲线Ⅱ可表示最适酶促条件下的曲线,该反应只能在细胞内进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在室温下可能大量共存的是( )
A. pH=2的溶液:HCO3-、Na+、ClO-、NO3-
B. 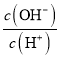 =106的溶液:Al3+、NH4+、Cl-、S2-
=106的溶液:Al3+、NH4+、Cl-、S2-
C. 水电离出的c(H+)=10-4 mol/L的溶液:Na+、K+、SO42-、CO32-
D. 使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是( )
A. 原子半径:W>Z>Y>X>M
B. 将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐
C. 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键
D. CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
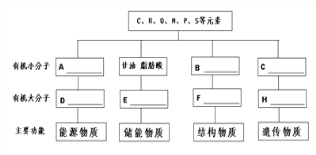
(1)A一般是指_____________;D在动物细胞中是指__________。
(2)E 是指_____________,它还有___________________的功能。
(3)B是指____________,其结构通式是______________,B形成[F]_________ 的过程叫____________。
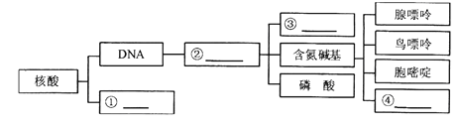
(4)如图中,是指______________,②是指______________,其中③是指___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
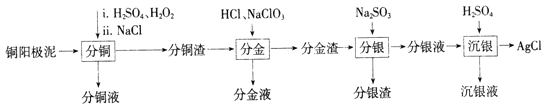
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
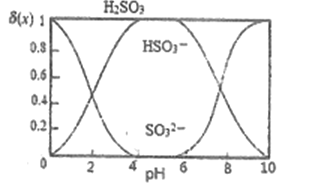
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com