
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+ O2(g) ![]() 2SO3(g);下列说法一定表明反应达到平衡状态的是( )
2SO3(g);下列说法一定表明反应达到平衡状态的是( )
A. 生成 SO3 为2 mol
B. SO3的生成速率等于2倍 O2的生成速率
C. SO2 和 SO3 物质的量之和为 2mol
D. 气体的密度不变
【答案】B
【解析】
本题考查判断化学平衡的依据。A.对于可逆反应,反应物不可能完全转化为生成物;B.化学平衡是动态平衡,当可逆反应达到平衡时,正逆反应速率相等;C.根据质量守恒,含有硫原子的物质只有二氧化硫和三氧化硫,无论2SO2(g)+ O2(g)![]() 2SO3(g)是否达到平衡,SO2 和SO3 物质的量之和一定和开始加入的SO2的物质的量相等;D.气体的密度是混合气体的质量除以混合气体的体积。
2SO3(g)是否达到平衡,SO2 和SO3 物质的量之和一定和开始加入的SO2的物质的量相等;D.气体的密度是混合气体的质量除以混合气体的体积。
A、该反应为可逆反应,1mol氧气完全反应才能生成2mol二氧化硫,因为可逆反应不可能完全转化成生成物,所以生成的三氧化硫的物质的量小于2mol,故A错误;B、根化学反应中各物质速率之比就等于化学反应计量数之比,当可逆反应达到平衡时,正逆反应速率相等,所以SO3的生成速率等于2倍 O2的生成速率时,表明化学反应达到了平衡状态 ,故B正确;C、根据质量守恒,含有硫原子的物质只有二氧化硫和三氧化硫,反应前加入2mol二氧化硫,所以无论2SO2(g)+ O2(g)![]() 2SO3(g)是否达到平衡,SO2和SO3 物质的量之和一定为 2mol,故C错误;D.因为气体的密度是混合气体的质量除以混合气体的体积。一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,说明混合气体的质量和体积都是定值,所以混合气的的密度也不会变,因此不能用密度是否改变判断可逆反应是否达到平衡。故D错误;本题答案为:B。
2SO3(g)是否达到平衡,SO2和SO3 物质的量之和一定为 2mol,故C错误;D.因为气体的密度是混合气体的质量除以混合气体的体积。一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,说明混合气体的质量和体积都是定值,所以混合气的的密度也不会变,因此不能用密度是否改变判断可逆反应是否达到平衡。故D错误;本题答案为:B。


科目:高中化学 来源: 题型:
【题目】牙齿洁白,人人喜欢。将漂白剂沾在牙套上,牙齿咬住牙套可使牙齿变得洁白。下列物质溶于水后所得溶液可作为牙齿漂白剂的是
A.Cl2 B.HNO3 C.Na2O2 D.H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH,从产生氢气的剧烈程度可推断出这三种物质产生H+的难易程度是(从难到易的顺序)( )
A. ①②③ B. ②③① C. ③①② D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元素 ①~⑩在表中的位置回答下列问题.
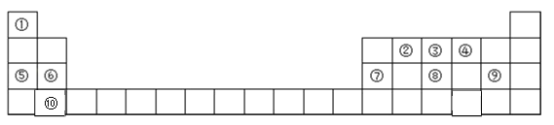
(1)在这 10 种元素中,原子半径最大的是_________(填元素符号)。
(2)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是______>_____(填化学式)。
(3)写出①、④元素组成比为1:1的化合物的电子式是_________。
(4)④⑤⑥⑦对应的离子半径最小的是_________(填离子符号)。
(5)写出实验室制取③的气态氢化物的化学方程式_________。
(6)⑦单质可用来制造⑦—空气燃料电池,该电池通常以氯化钠或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。若以氯化钠为电解质溶液时,正极的反应式为_________。若以氢氧化钾溶液为电解质溶液时,电池的总反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化肥生产中的废催化剂(主要成分为Al2O3、K2O、少量的CoO、SiO2等)来制取明矾的工艺流程如图所示。
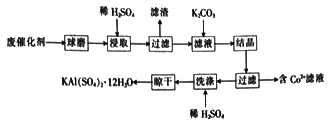
(1)KAl(SO4)2 12H2O中A1的化合价为__________。
(2)废催化剂在浸取前进行球磨的主要目的是______________。
(3)浸取时Al2O3溶解的化学方程式为_________;滤渣的主要成分是______________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2 12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/% | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的分子式为C2H2,B是合成塑料的单体,C的相对分子质量为78,M是一种具有广谱高效食品防腐作用的有机物,以A为原料合成B和M的路线如图所示。
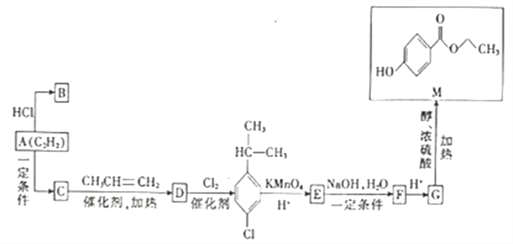
(1)C→D的反应类型为___________,B的结构简式为___________。
(2)写出E→F的化学方程式:_______________________________。
(3)G中的含氧官能团的名称是_______________,写出由G在一定条件下反应生成高分子化合物的化学反应方程式:_______________________________________。
(4)M的同分异构体有多种,写出四种满足以下条件的同分异构体的结构简式:___________、___________、___________、___________。
①能发生银镜反应
②含有萃环且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上同时连接两个-OH的结构不稳定)
(5)对甲基苯酚![]() 是重要的有机化工中间体,写出以乙炔、丙炔为原料(无机试剂任选)制备对甲基苯酚的合成路线:_________________________________________________。
是重要的有机化工中间体,写出以乙炔、丙炔为原料(无机试剂任选)制备对甲基苯酚的合成路线:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。以乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2),反应方程式为:C6H5—CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mo1-1
C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mo1-1
回答下列问题:
(1)已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mo1-1
C6H5—CH2CH3(g)+21/2O2(g)=8CO2(g)+5H2O(l) ΔH=-4607.1 kJ·mo1-1
则C6H5—CH=CH2(g)+10O2(g)= 8CO2(g)+4H2O(l) ΔH=_____________。
(2)工业上,在恒压设备中进行上述反应制取苯乙烯,常在乙苯蒸气中通入大量水蒸气。请用化学平衡理论解释通入大量水蒸气的原因_________________________________________。
(3)已知T℃下,将amol乙苯蒸气通入到体积为VL的密闭容器中进行上述反应,反应时间与容器内的总压强数据如下表:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总压强p/1000kPa | 1.0 | 1.3 | 1.45 | 1.5 | 1.5 |
①由表中数据计算0~10 min内v(C6H5—CH2CH3)=________________。(用含a、V 的式子表示)
②该反应平衡时乙苯的转化率为_________________________。
(4)苯乙烯与溴化氢发生的加成反应产物有两种,其反应方程式如下:
i.C6H5—CH=CH2(g)+HBr(g)![]() C6H5—CH2CH2Br (g)
C6H5—CH2CH2Br (g)
ii.C6H5—CH=CH2(g)+HBr(g)![]() C6H5—CHBrCH3(g)
C6H5—CHBrCH3(g)
600℃时,向3L 恒容密闭容器中充入1.2 mol C6H5—CH=CH2(g)和1.2 mol HBr(g)发生反应,达到平衡时C6H5—CH2CH2Br (g)和C6H5—CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
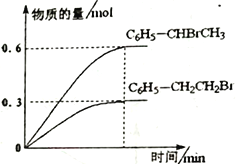
①600℃时,反应ii 的化学平衡常数K ii=__________________。
②反应平衡后,若保持其它条件不变,向该容器中再充入1mol C6H5—CH2CH2Br (g),则反应ii 将_________(“正向”、“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,判断反应已达到平衡状态的是______。
B.C6H5—CH2CH2Br (g)的生成速率与C6H5—CHBrCH3 (g)分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com