
【题目】化学中常借助于图像这一表现手段以清晰地突出实验装置的要点,形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是

A. 测定一定时间内生成H2的反应速率 B. 提取海带中的碘
C. 检验火柴燃烧产生的SO2 D. 证明非金属性:Cl>C>Si
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列所含分子数由多到少的排列顺序是_________________ ,
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃45gH2O
D.常温下,16gO2,与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A.Al(OH)3 → Al2O3 B.Al2O3 → Al(OH)3
C.Al → AlO2- D.Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起世界核大国的广泛重视。在爆炸的核电站周围含有放射性物质碘一131和铯一 137。碘—131—旦被人体吸入,可能会引发甲状腺等疾病。
(l)Cs(铯)的价电子的电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种金属元素X、Y、Z的电离能如下表
元素代号 | X | Y | Z |
第一电离能(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为_________,基态Z原子的核外电子排布式为______,X形成的单质晶体中含有的化学键类型是_________________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为______、______,BeF2分子的立体构型是____________,H2O分子的立体构型是________________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BC13分子中B—C1键的键角为__________________。
(4) 131I2晶体的晶胞结构如图甲所示,该晶胞中含有____个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻______个I-。

(5)KI晶体的密度为ρg cm 3,K和I的摩尔质量分别为MK g mol-1和MIg mol-1,原子半径分别为rKpm和rI pm,阿伏加德罗常数值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化,能通过一步化学反应完成的是( )
A. Al→Al(OH)3 B. N2→NO2
C. SiO2→Na2SiO3 D. SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验:
Ⅰ.查阅资料
①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
②2Na2S2O4+4HCl===4NaCl+S↓+3SO2↑+2H2O;
Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O。
Ⅱ.制备方法
75 ℃时将甲酸钠和纯碱加入乙醇溶液中,通入SO2进行反应,完成其反应的化学方程式:
________HCOONa+________Na2CO3+________===________Na2S2O4+________CO2+______
冷却至40~50 ℃,过滤,用________洗涤,干燥制得Na2S2O4。
Ⅲ.Na2S2O4的性质
(1)Na2S2O4溶液在空气中易被氧化。课题小组测定0.050 mol·L-1 Na2S2O4溶液在空气中pH变化如图所示:
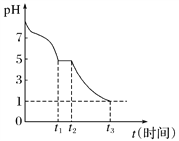
0~t1段主要生成HSO![]() ,根据pH变化图,HSO
,根据pH变化图,HSO![]() 的电离程度________(填“<”或“>”)水解程度。
的电离程度________(填“<”或“>”)水解程度。
0~t1段发生反应的离子方程式为_____________。
t3时溶液中存在的主要阴离子的符号是_________________。
(2)隔绝空气加热Na2S2O4固体完全分解;得到固体产物Na2SO3、Na2S2O3和________(填化学式)气体。
请你设计实验验证产物有Na2S2O3存在,完成下表中内容。
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
______ | _________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com