
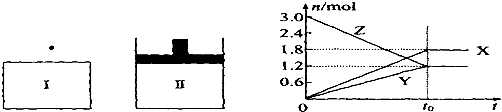
| A、该反应的化学方程式为:3X+2Y?3Z |
| B、若两容器中均达到平衡后,两容器的体积V(I)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t |
| C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D、达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
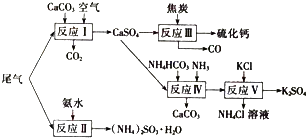
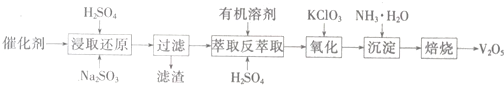
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、AgNO3、HNO3 |
| B、H2O、NaOH、HNO3 |
| C、H2O、NaOH、HCl |
| D、H2O、KOH、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳中所含的氯化氢(NaOH溶液) |
| B、氢气中所含的硫化氢(硫酸铜溶液) |
| C、乙酸乙酯中所含的乙酸(乙醇) |
| D、氯化钠溶液中所含的氯化钡(硫酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
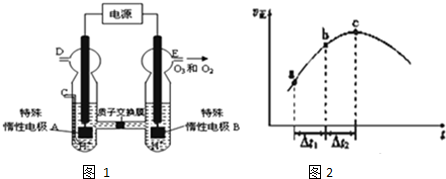
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCl |
| NaOH/H2O |
| △ |
| O2(Cu) |
| △ |
| HCN |
| 加成 |
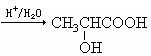
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com