
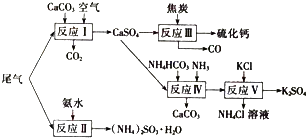
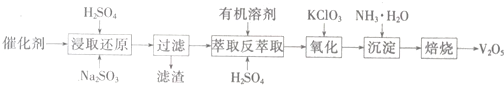


科目:高中化学 来源: 题型:
 已知
已知  可简写为
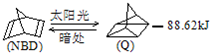
可简写为 利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )
利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )| A、物质Q比NBD更稳定 |
| B、物质Q的一氯取代物只有3种 |
| C、一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应 |
| D、NBD和Q二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、48g/mol |
| B、88g/mol |
| C、112g/mol |
| D、132g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
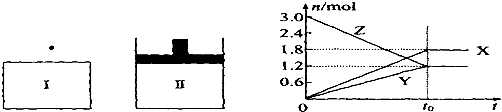
| A、该反应的化学方程式为:3X+2Y?3Z |
| B、若两容器中均达到平衡后,两容器的体积V(I)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t |
| C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D、达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com