
【题目】人们已步入“4G”时代,以光导纤维为基础的高速信息通道尤为重要.制造光导纤维的材料是( )
A.铜合金
B.橡胶
C.聚乙烯
D.二氧化硅
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物.一种用硼镁矿(Mg2B2O5H2O)制取单质硼的工艺流程图如下: 
回答下列问题:
(1)Mg2B2O5H2O中B的化合价为 .
(2)溶液b中溶质的化学式为 .
(3)用pH试纸测溶液pH的操作方法是 .
(4)写出Mg2B2O5H2O与盐酸反应的化学方程式:
(5)制得的粗硼在一定条件下生成BI3 , BI3加热分解可以得到纯净的单质硼.现将0.0200g粗硼制成的BI3完全分解,生成的I2用0.3000mo1.L﹣1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液15.00mL.(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)
①滴定操作中指示剂通常为
②该粗硼样品的纯度为 .
③若滴定管在使用前未用Na2S2O3标准溶液润洗,测得样品的纯度将(填“偏高”、“偏低”或“无影响”).
(6)请仿照如图形式设计从沉淀a中获得单质Mg的流程图(提示:在箭头上方或下方标出所用试剂或实验操作). ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一.
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
①C(s)+O2 (g)=CO2 (g)△H=﹣393.5kJmol﹣1
②CO(g)+ ![]() O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
③H2(g)+ ![]() O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 , 该反应的化学平衡常数K随温度的升高将(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 .
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2 , 负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式: , 若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式: , .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.在常温下,硅的化学性质活泼
D.硅是人类将太阳能转换为电能的常用材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:
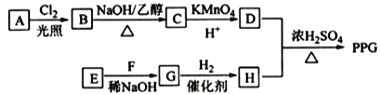
已知:①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④![]()
回答下列问题:
(1)A的结构简式为____________。
(2)由B生成C的化学方程式为___________________________。
(3)由E和F生成G的反应类型为_____________。
(4)由D和H生成PPG的化学方程式为_________________________。
(5)D的同分异构体中能同时满足下列条件的共有______种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是________(写结构简式)
(6)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填标号)。
a. 质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)C(s)△H<0,按照不同配比充入A,B,达到平衡时容器中A,B浓度变化如图中曲线(实线)所示,下列判断正确的是( ) 
A.T°C时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T°C
D.T°C时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.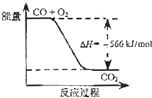
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下在固定容积的容器中进行的可逆反应:2M(g)+N(g)![]() Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
A. 密度增大 B. 平均相对分子质量增大
C. 总分子数增大 D. 平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com