
����Ŀ������ֲ���纣���к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڣ�ij�о���ѧϰС���������ʵ��Ӻ�������ȡ�⣬�����������������⣺
���� ![]() ������
������ ![]() ����������Һ
����������Һ ![]() ��I������Һ
��I������Һ ![]() ��I2��ˮ��Һ
��I2��ˮ��Һ ![]() ��I2�л���Һ
��I2�л���Һ ![]() ����⣮
����⣮
��1������ٵ�����Ϊ �� ��Ҫ�õ��������� ��
��2������ܵ����ӷ�ӦΪ ��
��3������ݵ�����Ϊ �� �ɹ�ѡ����Լ��������ţ���
A���ƾ� B�����Ȼ�̼ C������ D��������Һ��
��4���������鲽��ܺ�õ�����Һ�к��еⵥ�� ��
��5������ݵ�����Ϊ �� �������������������ƣ���ۼ���
���𰸡�
��1�����գ��������ƾ��ơ�������
��2��2I��+H2O2+2H+=I2+2H2O
��3����ȡ��Һ��B
��4�����������Һ��������ɫ��˵���еⵥ�ʣ���֮û��
��5����ȡ��������ƿ
���������⣺ʵ���ҴӺ�������ȡ�⣺�������ճɻң������ܽ�õ�����������Һ��ͨ�����ˣ��õ����ܵIJ�������ҺΪ�������ӵ���Һ���������������������������ɵⵥ�ʣ�H2O2+2I��+2H+=I2+2H2O�������л��ܼ���ȡ���ⵥ�ʣ���ͨ��������ȡ���ⵥ�ʣ� ��1��������ǹ������գ����չ�������һ��ʹ�ã��ɣ�������������������Ҫ��������֧��Ȼ��������ż��ϣ����ż�����Ŀռ�žƾ��ƣ�
���Դ��ǣ����գ��������ƾ��ơ������ǣ���2��������������Һ�м�����������Ϊ�˽���������������������������Һ�������ɵ��ʵ⣬���ӷ���ʽΪ2I��+H2O2+2H+=I2+2H2O��
���Դ��ǣ�2I��+H2O2+2H+=I2+2H2O����3���������ǽ���ˮת��Ϊ������л���Һ�����ö�±�ص����ܽ�����ǿ���л��ܼ��ѵ�ӵ�ˮ����ȡ��������Ӧ���е�ʵ���������ȡ�����õ��������л��ܼ���������������ȡ�����õ��������л��ܼ���������������ȡ����ע�⣺ѡ�������ȡ����Լ����˶�I2��ǿ���ܽ���������������������ˮ�������ܽ��з�Һ���룬���������������Ȼ�̼���ƾ������ᡢ���Ƕ�������ˮ�����ֲܷ㣬
���Դ��ǣ���ȡ��Һ��B����4������������Һ����ɫ�����Կ����õ�����Һ�����Ƿ��е⣬����鷽��Ϊ�������Һ�еμӵ�����Һ�������Һ����ɫ����֤�����е⣬�����⣬
���Դ��ǣ����������Һ��������ɫ��˵���еⵥ�ʣ���֮û�У���5���������������ɵⵥ�ʣ������л��ܼ�����ȡ���ⵥ�ʢݣ����Բ���ݵ�����Ϊ��ȡ�������������л��ܼ��е�ϵ����������Ե⾧��ۼ�����ƿ�У�
���Դ��ǣ���ȡ��������ƿ��


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϲ�����仯�����2009��12��7��18���ڸ籾�����ٿ����й�������ŵ��2020�꣬��λGDP������̼�ŷű�2005���½�40%��45%��
��1����Ч����̼�����ֶ�֮һ�ǽ��ܣ��������ⷽ������ܵ���
A.���ˮ���⣺2H2O2H2��+O2��
B.����ʹˮ�ֽ����⣺2H2O2H2��+O2��
C.̫������ֽ�ˮ���⣺2H2O TiO2̫���� 2H2��+O2��
D.��Ȼ�����⣺CH4+H2O CO+3H2
��2����CO2�������ϳ�CH3OCH3�����ѣ��ǽ����ԴΣ�����о�����֮һ��
��֪��CO��g��+2H2��g���TCH3OH��g����H=��90.7kJmol��1
2CH3OH��g���TCH3OCH3��g��+H2O��g����H=��23.5kJmol��1
CO��g��+H2O��g���TCO2��g��+H2��g����H=��41.2kJmol��1
��CO2�������ϳ�CH3OCH3��g�����Ȼ�ѧ����ʽΪ
��3���ڴ�����һ���¶ȡ�ѹǿ�����£�CO��H2�ɷ�Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����p1p2�����������������=����ͬ����������Ӧ�ġ�H0�� 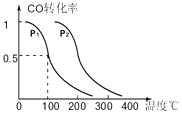
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ�����ǻ�ѧʵ��������в����������������Ⱦ���ǣ� ��
A.��Ũ����ϴ�Ӽ���KMnO4���������Թ�
B.��ϡ����ϴ����������ʵ����Թ�
C.���������������Һһͬ�����Һ��
D.�����Ƶ�ˮ���¶ȼƲ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. Ԫ�����ڱ���18�����У�ÿһ��������һ��
B. 34��Ԫ��λ�ڵ�������VA��
C. ֻ��һ��Ԫ����ɵ�����һ���Ǵ�����
D. ͬ��������֮����ת�����ڻ�ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ҵ�����У�ʯ��ʯ����ʯ�ҡ���ʯ�Ҷ�������Ϊԭ�ϵ���( )
������ ������������ �۴Ӻ�ˮ����ȡþ ������ұ�� ����ˮ�� ���Ʋ��� ����Ư�� ��������
A.�ܢ�
B.�ݢ�
C.�٢ڢ�
D.�ݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AIN)��һ���������ǽ������ϡ�ijAlN��Ʒ������ֺAl2O3���ʣ�Ϊ�ⶨAlN�ĺ����������������ʵ�鷽����
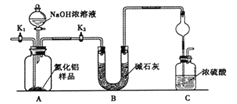
��1����ͼCװ�������θ���ܵ�������_____________________��
��2��ʵ�鲽�裺��װ��ʵ��װ�ã�����װ���������ټ���ʵ��ҩƷ���������ر�K1����K2����Һ©������������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ��____________________��
��3������װ�ô���ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ����__________________��
������2������ͼװ�òⶨmg��Ʒ��A1N�Ĵ��ȣ����ּг�װ������ȥ����
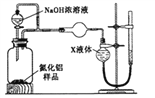
��4��Ϊ�ⶨ������������������װ���е�XҺ�岻������_____________________��
A.NH4Cl��Һ b.CCl4 c.H2O d.��
��5����ag��Ʒ��ȫ��Ӧ�����������������ΪbmL����ת��Ϊ��״��������AlN������������__________��
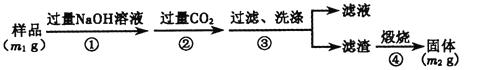
��6��д�������з����Ļ�ѧ��Ӧ����ʽ_______________________________��
��7�����ڲ������δϴ�ӣ��ⶨ�����______������ƫ��������ƫ����������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ũ������ϡ���ᣬ�ȼ��ֿɿ��ķ����ǣ�������
A. ��ȡ������Һ�ֱ����ͭƬ B. �ֱ���ʯ����Һ����
C. ��ȡ������Һ����BaCl2��Һ D. ��ȡ������Һ�ֱ������Ƭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������ԭ��Ӧ�������У���ȷ���ǣ� ��
A.�е��ʲμӵķ�Ӧһ����������ԭ��Ӧ
B.ȼ�շ�Ӧ������������������
C.2Fe+3Cl2�T2FeCl3�� Fe+S ![]() FeS �ɴ˿����ж������ԣ�Cl2��S
FeS �ɴ˿����ж������ԣ�Cl2��S
D.Mg�ڻ�ѧ��Ӧ��ʧȥ2�����ӣ���Al�ڻ�ѧ��Ӧ��ʧȥ3�����ӣ���˻�ԭ��Al��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����úת��Ϊ�������ȼ�ϣ�
��֪��2H2(g)+ O2(g)��2H2O(g) ��H= ��483.6kJ/mol
C(s)+1/2O2(g)��CO(g) ��H= ��110.5kJ/mol
д����̿��ˮ������Ӧ�� H2 �� CO ���Ȼ�ѧ����ʽ_____________��
��2��һ���������ܱ������ڣ�SO2 �������� SO3 ���Ȼ�ѧ����ʽΪ��2SO2(g)+O2(g)2SO3(g)��H=��a kJ/mo1������ͬ������Ҫ��ų� 2akJ ��������������ʵ����ʵ���������_______��
A��4mo1 SO2 �� 2mol O2 B��2mol SO2��1mo1O2
C��4mol SO2 �� 4mo1O2 D��6mo1SO2 �� 4mo1O2
��3������β���� NOx �� CO �����ɼ�ת����
����֪���������� NO �ķ�ӦΪ��N2(g)+O2(g) ![]() 2NO(g)����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����_______��
2NO(g)����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����_______��
A��ѹǿ���� B���������ƽ����Է�����������
C��2v ��(N2)��v ��(NO) D��N2 ������������ٸı�
������ȼ�Ͳ���ȫȼ��ʱ���� CO���������밴���з�Ӧ��ȥ CO��2CO(g)=2C(s)+O2(g)��H>0�������������ܷ�ʵ�ֵ�����___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com