
【题目】(1)将煤转化为清洁气体燃料:
已知:2H2(g)+ O2(g)=2H2O(g) △H= -483.6kJ/mol
C(s)+1/2O2(g)=CO(g) △H= -110.5kJ/mol
写出焦炭与水蒸气反应制 H2 和 CO 的热化学方程式_____________。
(2)一定条件下密闭容器内,SO2 被氧化成 SO3 的热化学方程式为:2SO2(g)+O2(g)2SO3(g)△H=-a kJ/mo1,在相同条件下要想放出 2akJ 热量,加入各物质的物质的量可能是_______。
A.4mo1 SO2 和 2mol O2 B.2mol SO2、1mo1O2
C.4mol SO2 和 4mo1O2 D.6mo1SO2 和 4mo1O2
(3)汽车尾气中 NOx 和 CO 的生成及转化:
①已知气缸中生成 NO 的反应为:N2(g)+O2(g) ![]() 2NO(g),在一定温度下的定容密闭容器中,能说明此反应已达平衡的是_______。
2NO(g),在一定温度下的定容密闭容器中,能说明此反应已达平衡的是_______。
A.压强不变 B.混合气体平均相对分子质量不变
C.2v 正(N2)=v 逆(NO) D.N2 的体积分数不再改变
②汽车燃油不完全燃烧时产生 CO,有人设想按下列反应除去 CO:2CO(g)=2C(s)+O2(g)△H>0,简述该设想能否实现的依据___________。
【答案】 C(s)+H2O (g)=H2(g)+CO(g)△H=+131.3kJ/mol D CD 不能实现。该反应是焓增、熵减的反应,根据 G=H-T S,G>0,反应不能自发进行
【解析】(1)①:2H2(g)+ O2(g)=2H2O(g) △H1= -483.6kJ/mol
②C(s)+1/2O2(g)=CO(g) △H2= -110.5kJ/mol
根据盖斯定律,由②-①×![]() 得C(s)+H2O(g)=CO (g)+H2(g) △H=△H2-△H1×
得C(s)+H2O(g)=CO (g)+H2(g) △H=△H2-△H1×![]() = -110.5kJ/mol-(-483.6kJ/mol) ×
= -110.5kJ/mol-(-483.6kJ/mol) ×![]() =+131.3 kJ/mol;(2)要想得到2a kJ的热量,则必须消耗4molSO2和2mol O2,又因为是可逆反应,转化率不可能是100%的,所以只有D符合;答案选D;(3)①A.由于反应前后体积不变,故压强始终不变不能做为平衡判断依据,选项A错误; B.由于反应前后总质量和总物质的量都不改变,故混合气体平均相对分子质量不变,故不能做为平衡判断依据,选项B错误;C、根据化学反应速率之比等于计量数之比,有:2v 正(N2)=v 正(NO),故2v 正(N2)=v 逆(NO)表示正逆反应速率相等,能做为平衡判断依据,选项C正确;D、N2 的体积分数不再改变,说明已达平衡状态,选项D正确。答案选CD;②由反应2CO(g)=2C(s)+O2(g) △H>0,可知该反应是焓增、熵减的反应。根据△G=△H—T△S, △G>0,反应不能自发进行。
=+131.3 kJ/mol;(2)要想得到2a kJ的热量,则必须消耗4molSO2和2mol O2,又因为是可逆反应,转化率不可能是100%的,所以只有D符合;答案选D;(3)①A.由于反应前后体积不变,故压强始终不变不能做为平衡判断依据,选项A错误; B.由于反应前后总质量和总物质的量都不改变,故混合气体平均相对分子质量不变,故不能做为平衡判断依据,选项B错误;C、根据化学反应速率之比等于计量数之比,有:2v 正(N2)=v 正(NO),故2v 正(N2)=v 逆(NO)表示正逆反应速率相等,能做为平衡判断依据,选项C正确;D、N2 的体积分数不再改变,说明已达平衡状态,选项D正确。答案选CD;②由反应2CO(g)=2C(s)+O2(g) △H>0,可知该反应是焓增、熵减的反应。根据△G=△H—T△S, △G>0,反应不能自发进行。


科目:高中化学 来源: 题型:
【题目】海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:
海带 ![]() 海带灰
海带灰 ![]() 海带灰悬浊液
海带灰悬浊液 ![]() 含I﹣的溶液
含I﹣的溶液 ![]() 含I2的水溶液
含I2的水溶液 ![]() 含I2有机溶液
含I2有机溶液 ![]() 晶体碘.
晶体碘.
(1)步骤①的名称为 , 需要用到的仪器有 .
(2)步骤④的离子反应为 .
(3)步骤⑤的名称为 , 可供选择的试剂是(填编号).
A.酒精 B.四氯化碳 C.乙酸 D.蔗糖溶液.
(4)怎样检验步骤④后得到的溶液中含有碘单质 .
(5)步骤⑤的名称为 , 最后晶体碘在(填仪器名称)里聚集.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
a | b | c | |
A | N2 | NO | NO2 |
B | S | SO2 | SO3 |
C | Si | SiO2 | H2SiO3 |
D | Fe | FeCl2 | FeCl3 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以 0.1000 mol·L-1 的 NaOH 溶液滴定 20.00mL 未知浓度的稀盐酸,滴定操作可分解为如下几步(所用的仪器已检漏且刚用蒸馏水洗净):
A.用酸式滴定管向锥形瓶里注入 20.00mL 待测稀盐酸溶液,并加入 2~3 滴酚酞;
B.用标准 NaOH 溶液润洗碱式滴定管 2~3 次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.将标准 NaOH 溶液注入碱式滴定管至刻度 0 以上 2~3cm ;
E.调节液面至 0 或 0 刻度以下,记下读数;

F.把锥形瓶放在滴定管的下面,用标准 NaOH 溶液滴定至终点并记下滴定管液面的刻度。
(1)正确操作步骤的顺序是(用序号字母填写)B_______F ;
(2)滴定达到终点的现象_________。
(3)用标准 NaOH 溶液滴定时,应将标准 NaOH 溶液注入_____(右图“甲”或“乙”)中。
(4)滴定时边滴边摇动锥形瓶,眼睛应观察_______。
(5)据下列数据计算,待测盐酸溶液的浓度为 ____mol·L-1 (计算结果保留小数点后四位)
实验编号 | 待测盐酸体积(m L) | 滴定前 NaOH 溶液的体积读数(mL) | 滴定后 NaOH 溶液 的体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(6)下列操作会导致测定结果偏低的是____。
A.碱式滴定管未用标准 NaOH 溶液润洗就装标准液滴定
B.读取标准液读数时,滴前仰视,滴定到终点后俯视
C.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失
D.酸式滴定管没有用待测盐酸润洗,直接装入待测盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并进行了其他有关实验.(图中夹持及尾气处理装置均已略去) 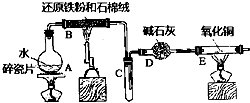
(1)装置B中发生反应的化学方程是
(2)装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.
①欲检验溶液中含有Fe3+ , 选用的试剂为 , 现象是 .
②该实验小组同学用上述试剂没有检测到Fe3+ , 用离子方程式解释滤液中不存在Fe3+可能的原因: .
③在此溶液中加入少量酸性高锰酸钾溶液,高锰酸钾褪色,溶液中反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ga、As、Al、C的相关化合物在化工和医学领域有着广泛的应用。回答下列问题:
(1)写出基态Ga原子的核外电子排布式:_________,有_____个未成对电子。
(2)合金砷化镓在现代工业中被广泛应用,Ga、As电负性由大到小排序为______________。
(3)1个丙二烯分子中σ键总数为___个,C原子的杂化方式为______。分子中的大π键可以用符号пmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为п66),则丙二烯中的大π键应表示为____________。
(4)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:

①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0, 0, 0);B为(1/2,1/2,0);C为(1,0,1)。则D原子的坐标参数为_________________。
②已知氮化镓晶胞的边长为a nm,其密度为d g/cm3,则阿伏加德罗常数NA =____(用a、d表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)在Fe3O4+4CO ![]() 3Fe+4CO2的中,是还原剂,元素被还原,当有标状下的CO气体560ml完全反应时,生成Fe是克.
3Fe+4CO2的中,是还原剂,元素被还原,当有标状下的CO气体560ml完全反应时,生成Fe是克.
(2)下列物质能导电的是(用序号填空,下同)属于电解质的是 , 属于非电解质的是 .
①水银 ②烧碱 ③大理石 ④氯化钠晶体 ⑤盐酸
⑥氨气 ⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与电化学腐蚀无关的是( )
A.光亮的自行车钢圈不易生锈
B.黄铜(Cu、Zn合金)制的铜锣不易产生铜绿
C.铜、铝电线一般不连接起来作导线
D.生铁比熟铁(几乎是纯铁)容易生锈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com