
【题目】某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并进行了其他有关实验.(图中夹持及尾气处理装置均已略去) 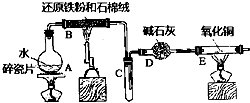
(1)装置B中发生反应的化学方程是
(2)装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.
①欲检验溶液中含有Fe3+ , 选用的试剂为 , 现象是 .
②该实验小组同学用上述试剂没有检测到Fe3+ , 用离子方程式解释滤液中不存在Fe3+可能的原因: .
③在此溶液中加入少量酸性高锰酸钾溶液,高锰酸钾褪色,溶液中反应的离子方程式 .
【答案】
(1)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(2)黑色氧化铜变红,玻璃管右端出现无色液滴
(3)硫氰化钾(KSCN);溶液变红;2Fe3++Fe=3Fe2+;5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O
【解析】解:(1)装置B中发生反应的化学方程是3Fe+4H2O(g) ![]() Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g)
Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2;(2)E中氢气还原CuO生成Cu、水,则观察到的现象为黑色氧化铜变红,玻璃管右端出现无色液滴,所以答案是:黑色氧化铜变红,玻璃管右端出现无色液滴;(3)①欲检验溶液中含有Fe3+ , 选用的试剂为硫氰化钾(KSCN),现象是溶液变红,所以答案是:硫氰化钾(KSCN);溶液变红;
Fe3O4+4H2;(2)E中氢气还原CuO生成Cu、水,则观察到的现象为黑色氧化铜变红,玻璃管右端出现无色液滴,所以答案是:黑色氧化铜变红,玻璃管右端出现无色液滴;(3)①欲检验溶液中含有Fe3+ , 选用的试剂为硫氰化钾(KSCN),现象是溶液变红,所以答案是:硫氰化钾(KSCN);溶液变红;
②该实验小组同学用上述试剂没有检测到Fe3+ , 用离子方程式解释滤液中不存在Fe3+可能的原因为2Fe3++Fe=3Fe2+ , 所以答案是:2Fe3++Fe=3Fe2+;
③在此溶液中加入少量酸性高锰酸钾溶液,高锰酸钾褪色,亚铁离子具有还原性,溶液中反应的离子方程式为5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,
所以答案是:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各工业生产中,石灰石、生石灰、熟石灰都不能作为原料的是( )
①炼铁 ②用生铁炼钢 ③从海水中提取镁 ④铝的冶炼 ⑤制水泥 ⑥制玻璃 ⑦制漂白粉 ⑧制硫酸
A.④⑧
B.⑤⑥
C.①②③
D.⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,99 ml 0.1 mol/L盐酸和101 ml 0.05 mol/L氢氧化钡溶液相混和(忽略混合后溶液的体积变化),则混合后溶液的pH值为( )
A. 1.7 B. 10.7 C. 11 D. 11.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式按要求书写正确的是( )
A. 向NH4Al(SO4)2溶液中滴入少量NaOH溶液:Al 3++3OH= A l(OH)3↓
B. 从酸化的海带灰浸出液中提取碘:2I+H2O2 = I2+2OH
C. 向含有0.1mol NaOH和0.1mol Na2CO3的溶液中加入1L 0.4mol/L的稀盐酸OH+CO32+3H+ = CO2↑+2H2O
D. 明矾净水是因为产生Al(OH)3胶体:Al3++3H2O=== A l(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.01mol的铁、铝混合物溶于100mL 0.2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=16mL时,则V2为( ) 
A.24mL
B.30mL
C.440mL
D.44mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将煤转化为清洁气体燃料:
已知:2H2(g)+ O2(g)=2H2O(g) △H= -483.6kJ/mol
C(s)+1/2O2(g)=CO(g) △H= -110.5kJ/mol
写出焦炭与水蒸气反应制 H2 和 CO 的热化学方程式_____________。
(2)一定条件下密闭容器内,SO2 被氧化成 SO3 的热化学方程式为:2SO2(g)+O2(g)2SO3(g)△H=-a kJ/mo1,在相同条件下要想放出 2akJ 热量,加入各物质的物质的量可能是_______。
A.4mo1 SO2 和 2mol O2 B.2mol SO2、1mo1O2
C.4mol SO2 和 4mo1O2 D.6mo1SO2 和 4mo1O2
(3)汽车尾气中 NOx 和 CO 的生成及转化:
①已知气缸中生成 NO 的反应为:N2(g)+O2(g) ![]() 2NO(g),在一定温度下的定容密闭容器中,能说明此反应已达平衡的是_______。
2NO(g),在一定温度下的定容密闭容器中,能说明此反应已达平衡的是_______。
A.压强不变 B.混合气体平均相对分子质量不变
C.2v 正(N2)=v 逆(NO) D.N2 的体积分数不再改变
②汽车燃油不完全燃烧时产生 CO,有人设想按下列反应除去 CO:2CO(g)=2C(s)+O2(g)△H>0,简述该设想能否实现的依据___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业与人类的生产生活息息相关,回答下列问题:
已知反应: Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)写出 K 的表达式__________________。
(2)反应中的 a____________0(填“>”、“<”或“=”)。
(3)若 500℃时进行反应,CO2 起始浓度为 3molL-1,CO 的平衡浓度为______molL-1。
(4)700 ℃时反应达到平衡,要使该平衡向右移动且能增大 CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.升高温度到 900 ℃ B.通入 CO2
C.增加 Fe 的量 D.使用合适的催化剂
(5)700℃反应达到平衡,此时增大反应中 CO 的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和 CO2 的体积比值__________(填“增大”、“减小”或 “不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用惰性电极电解硫酸铜溶液: 2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 在强碱溶液中NaClO与Fe(OH)3 反应生成NaFeO4: 3C1O-+2Fe(OH)3=2FeO42-+3C1-+H2O+4H+
C. 向NaAlO2溶液中通入过量CO2制取Al(OH)3: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 用浓盐酸酸化的KMnO4溶液氧化H2C2O4: 6H++5H2C2O4+2MnO4-=10CO2↑+2Mn2++8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com